La vaccination préventive est un outil puissant permettant de contrôler les épidémies virales. Il est important que les effets secondaires, qui peuvent accompagner leur utilisation, soient le plus faible et le moins grave possible. Des chercheurs de l’Institut Pasteur ont cherché à comprendre les raisons de rares effets secondaires neurologiques rencontrés dans le vaccin amaril (fièvre jaune). Pour cela, ils ont étudié une souche vaccinale, dite FNV, qui n’est plus utilisée depuis les années 80 car elle provoquait un nombre trop élevé d’effets secondaires d’ordre neurologique. Les conclusions tirées de l’étude de cet ancien vaccin sont riches d’enseignement pour les vaccins actuels.
Le vaccin actuel contre la fièvre jaune est un vaccin vivant atténué d’une très grande efficacité. Il est considéré comme l’un des vaccins les mieux tolérés parmi les vaccins utilisant des virus vivants atténués. Ce vaccin, nommé Stamaril, est ainsi largement utilisé pour lutter contre les épidémies en Amérique du Sud et sur le continent africain, qui continuent de causer plus de 70 000 décès chaque année.
Dans de très rares cas, des effets secondaires, d’ordre neurologique, sont parfois observés (0.000012–0.00002% des patients vaccinés). Toutefois, face aux bénéfices considérables apportés par le vaccin, les recommandations pour les zones à risque restent inchangées : la réglementation internationale impose la vaccination anti-fièvre jaune avant un voyage en zone endémique (un passeport vaccinal est demandé à l’entrée des pays endémiques). Une seule injection permet une protection à long terme. (voir la fiche maladie de l’Institut Pasteur).
Les travaux menés par les unités de Neuroimmunologie virale et de Signalisation antivirale à l’Institut Pasteur, avec leurs partenaires académique (Sorbonne Université, Institut de Biologie Intégrative de la Cellule) et industriel (Sanofi Pasteur), visent ici à comprendre les déterminants viraux à l’origine de ces effets secondaires. Plus particulièrement, comment les particules vaccinales, ainsi que les virus véhiculés par la circulation sanguine, peuvent avoir accès au cerveau - normalement protégé par la barrière hémato-encéphalique de l’entrée de substances indésirables.
La capacité neuroinvasive des variants est coopérative
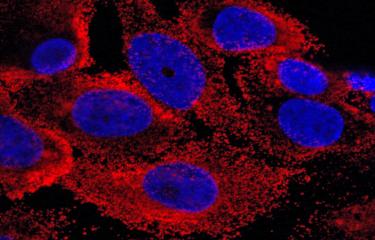
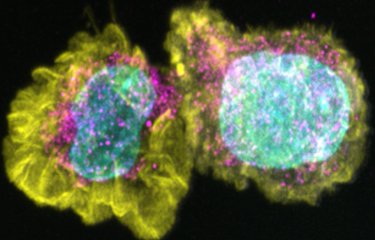
Les chercheurs ont utilisé un modèle de barrière hémato-encéphalique (mBHE) et une souche vaccinale appelée FNV (‘French Neurotropic Vaccine’) dont l’utilisation a été interrompue dans les années 1980 car elle induisait une fréquence plus élevée (0.3%) d’encéphalites. Les scientifiques ont ainsi confirmé que, comparée à la souche du vaccin Stamaril, la souche FNV était plus hétérogène et traversait plus fréquemment la mBHE. « Nous avons identifié dans le lot vaccinal plusieurs variants de FNV ayant la propriété de traverser efficacement la mBHE, indique Nolwenn Jouvenet, responsable de l’unité Signalisation antivirale. Contre toute attente, une fois isolés et étudiés individuellement, aucun des variants n’était plus neuroinvasif que la souche de départ. » Les variants n’ont retrouvé leur capacité neuroinvasive qu’après avoir été mélangés entre eux, ce qui suggère que le passage de la mBHE par la souche FNV est un phénomène coopératif. Il est donc attendu que plus un vaccin contient de variants, plus il aura facilement accès au cerveau.
La conclusion de cette étude suggère que l’innocuité d’un vaccin vivant Fièvre Jaune repose sur sa faible diversité génomique. Ce paramètre est un point important à prendre en considération dans la fabrication des vaccins viraux vivants.
Source :
Genomic diversity contributes to the neuroinvasiveness of the Yellow fever French neurotropic vaccine, nature partner journals Vaccines, 26 avril 2021
Florian Bakoa1,2,3,,6, Christophe Préhaud1,6, Guillaume Beauclair 4,5, Maxime Chazal4, Nathalie Mantel2, Monique Lafon1 and Nolwenn Jouvenet 4
1Unité de Neuroimmunologie Virale, Institut Pasteur, Paris, France.
2Research and External Innovation Department, Sanofi Pasteur, Marcy L’Etoile, Lyon, France.
3Sorbonne Université, Collège doctoral, Paris, France.
4Unité de Signalisation Antivirale, CNRS UMR 3569, Institut Pasteur, Paris, France.
5Institut de Biologie Intégrative de la Cellule, UMR9198, Équipe Autophagie et Immunité Antivirale, Faculté de Pharmacie, Châtenay-Malabry, Paris, France.
6These authors contributed equally
Cette étude entre dans le cadre de l’initiative Vaccinologie et immunothérapie du plan stratégique 2019-2023 de l’Institut Pasteur.