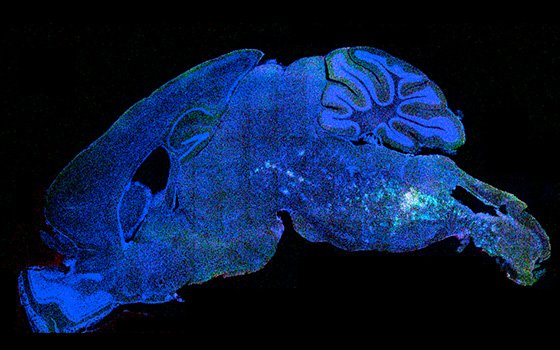
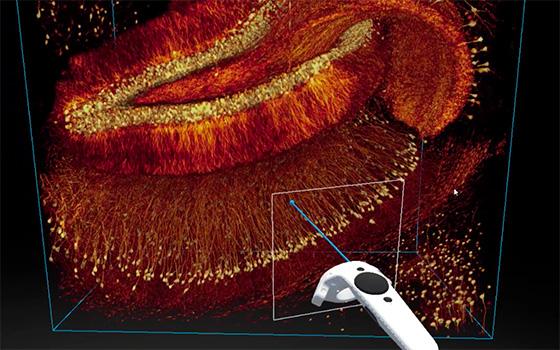
Le cerveau est un organe complexe, et son équilibre dépend des interactions harmonieuses avec le reste de notre corps. La quasi-totalité des troubles cérébraux se manifestent par une défaillance de la communication entre cellules cérébrales (neurones) et avec d’autres organes (intestin, système immunitaire, etc.). Nous les appelons « troubles de la connectivité cérébrale ». Cette super-famille de troubles neurologiques comprend : les pathologies neurodégénératives, les troubles neuro-développementaux, les troubles psychiatriques, les troubles sensorimoteurs, les maladies immunes et les pathologies cérébrales d’origine infectieuse.
Les troubles neurologiques et mentaux pèsent lourdement dans les dépenses de santé des pays à revenu élevé. Ensemble, ils représentent près de 25% des journées de travail perdues, un fardeau pour le système de santé qui dépasse à la fois celui des maladies cardiovasculaires et du cancer. Les troubles neurodéveloppementaux peuvent impacter la vie entière d’une personne. Par exemple, en France, l’autisme représente un coût de 1,4 milliard d’euros chaque année. L’allongement de la durée de vie a accru la prévalence des troubles liés à l’âge, et en particulier celle des troubles neurodégénératifs. La démence touche 36 millions de personnes dans le monde, dont 25 millions sont atteintes de la maladie d’Alzheimer. Cela représente un coût de plus de 480 milliards d’euros par an. En 2030, plus de 80 millions de personnes seront atteintes. L’augmentation de la prévalence de la maladie d’Alzheimer, de la maladie de Parkinson et d’autres pathologies neurodégénératives réclame de nouveaux efforts de recherche de mécanismes (moléculaires, cellulaires, physiologiques et associés aux pathogènes) qui permettront le développement de thérapies efficaces.
À l’Institut Pasteur, nous veillons à exploiter les diverses compétences en recherche fondamentale dans les domaines des neurosciences, de la génétique, de la biologie des cellules et du développement, de la biologie moléculaire et structurale, de l’immunologie, de la microbiologie et de la biologie des infections, et l’accès à des technologies de pointe pour appréhender la complexité des fonctions cérébrales et des maladies de la connectivité. Ce n’est que par cette démarche multidisciplinaire que nous pourrons comprendre les maladies du cerveau et développer des thérapies innovantes.
COORDINATEURS PRINCIPAUX
Chiara Zurzolo, responsable de l’unité Imagerie dynamique du neurone
David DiGregorio, responsable de l’unité Trafic membranaire et pathogénèse
STRATEGIE SCIENTIFIQUE
Pour atteindre ces objectifs, nous mettrons en place des approches techniques transversales tout en renforçant les approches existantes : analyses génomiques et cellulaires, mise au point de médicaments par une approche structurale pour les troubles de la connectivité cérébrale, microscopie innovante, approches de réseaux neuronaux et artificiels intacts, analyses de données intégratives, cellules souches et médecine régénérative avec comportement et physiologie d’organismes vivants de modèles humains et animaux, et développement de nouveaux outils et approches diagnostiques et thérapeutiques (notamment computationnels).
Les initiatives et projets communs porteront sur la recherche fondamentale (mécanistique) ou translationnelle (diagnostique / thérapeutique) dans les domaines suivants :
- Troubles neuro-développementaux et psychiatriques
- Troubles sensorimoteurs
- Pathologies neurodégénératives et cognitives liées à l’âge
- Troubles de la connectivité cérébrale causés par des microbes infectieux et commensaux
- Troubles d’ordre neuro-immunologique
- Approches régénératives des lésions et de la dégénérescence neuronales
- Nouvelles approches computationnelles d’appréhension des fonctions cérébrales ou de diagnostic et de traitement des troubles neurologiques
Nous avons identifié les thématiques de recherche suivantes :