En collaboration avec le Réseau International des Institut Pasteur (Institut Pasteur de Guadeloupe, Institut Pasteur de la Guyane, Instituto Oswaldo Cruz-Fiocruz, Institut Pasteur de Nouvelle-Calédonie) et le Centre de Démoustication/Collectivité territoriale de la Martinique, l’unité Arbovirus et Insectes Vecteurs de l’Institut Pasteur, dirigée par Anna-Bella Failloux, a entrepris l’étude de la compétence vectorielle de sept populations d’Aedes aegypti et d’Aedes albopictus récoltées en Guadeloupe, en Guyane française, à la Martinique, au Brésil et aux Etats-Unis.
Ces moustiques ont été infectés avec une souche du virus Zika de génotype asiatique comparable à celle qui circule actuellement en Amérique. Les scientifiques ont « traqué » le virus dans le moustique pour analyser la capacité de ce dernier d’une part à s’infecter après la prise d’un repas de sang contenant le virus, d’autre part à assurer la multiplication du virus dans sa cavité générale (à l’intérieur du moustique) après franchissement de la barrière de l’estomac, et enfin à transmettre le virus par une piqûre, à partir des glandes salivaires et de la salive – une étape essentielle pour que la transmission soit possible.
Les résultats publiés dans PLoS Neglected Tropical Diseases montrent que bien qu’Aedes aegypti et Aedes albopictus soient tous deux capables de s’infecter et de disséminer le virus en leur sein (deux premières étapes), ils sont en revanche très peu compétents à transmettre le virus Zika au cours d’une piqûre.
Les scientifiques ont en effet démontré que la transmission du virus n’était observée que 14 jours après la prise d’un repas de sang infectieux. Cette période, nécessaire au virus pour parcourir l’ensemble du « trajet » dans le moustique jusqu’aux glandes salivaires, est donc relativement longue, comparée à celle observée pour le virus chikungunya, qui est de l’ordre de 2-3 jours. Cette information devrait être mise à profit pour organiser au mieux la lutte antivectorielle qui demeure la seule méthode efficace pour circonscrire l’épidémie de Zika.
Ainsi, d’après les scientifiques, plus que la compétence vectorielle des moustiques d’Amérique, l’importante population humaine naïve sur le plan immunitaire pour ce nouveau virus vivant à proximité d’une forte densité de moustiques vecteurs pourraient plus probablement expliquer la diffusion rapide du virus Zika en Amérique.
Quelques informations sur le virus Zika et son vecteur moustique
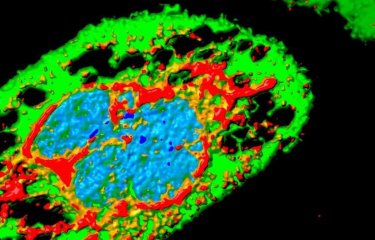
Le virus Zika (voir image ci-dessous) isolé pour la première fois en 1947 d'un singe dans la foret Zika à Kampala (Ouganda), a été ré-isolé l’année suivante d’un moustique de canopée piquant peu l’homme, Aedes africanus. C’était la preuve que ce virus d’origine africaine est bien un arbovirus (contraction anglosaxone pour arthropod-borne virus). Ce virus appartient à la même famille que les virus de la dengue et la fièvre jaune (Flaviviridae), avec lesquels il partage les mêmes vecteurs qui sont principalement des moustiques du genre Aedes (qui piquent essentiellement durant la journée).
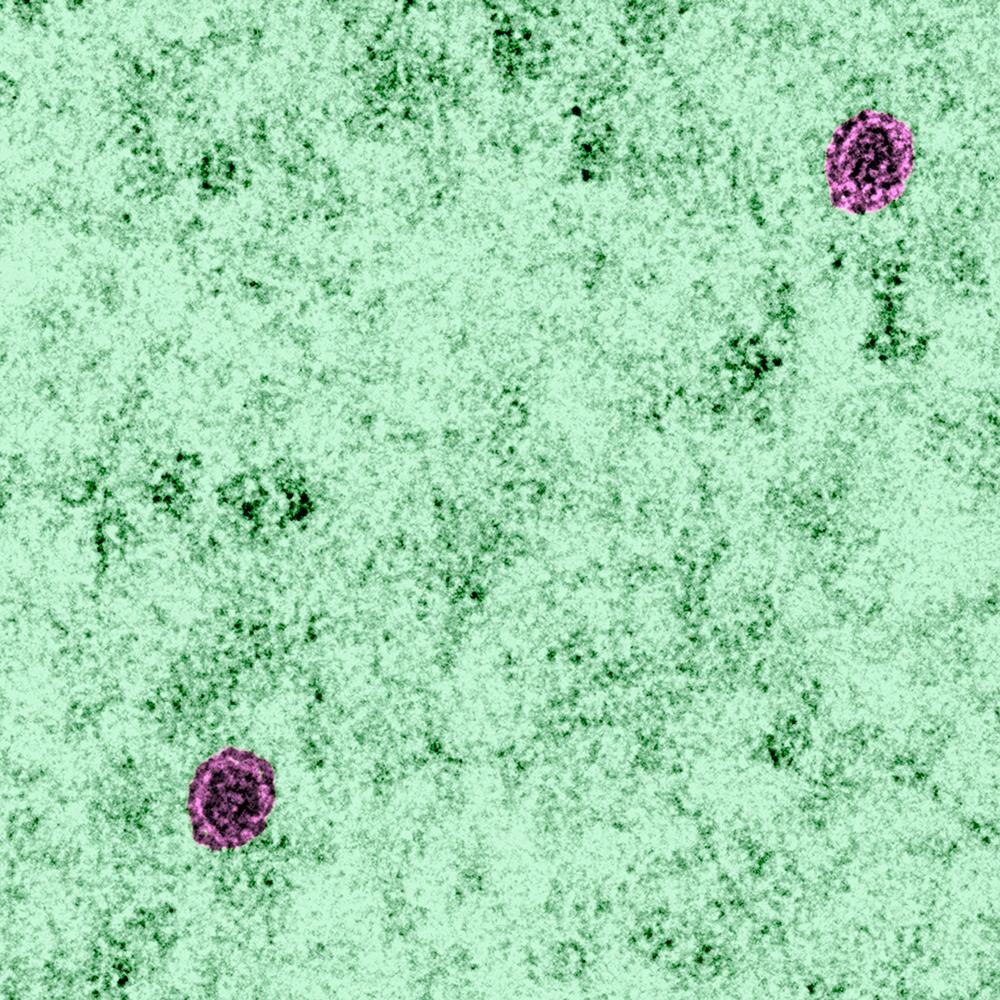
Cellules infectées par le virus du Zika en microscopie électronique à transmission. © Institut Pasteur
Le virus Zika circule de façon traditionnelle au sein d’un cycle selvatique impliquant des moustiques zoophiles et des primates non humains. Un cycle épidémique est principalement associé à une transmission du virus par un moustique anthropophile, prenant ses repas principalement sur l’homme. C’est le cas d’Aedes aegypti, le vecteur impliqué dans les épidémies de Zika en Polynésie française en 2013-2014, en Nouvelle-Calédonie en 2014 et dans d’autres îles du Pacifique. En mai 2015, le virus Zika est détecté dans le Nord-Ouest du Brésil, qui a été le point de départ d’une épidémie qui a fait jusqu’à ce jour plus 1,5 millions de cas. Il est rapporté dans plus de 26 pays d’Amérique latine et de la Caraïbe.
Source
Differential susceptibilities of Aedes aegypti and Aedes albopictus from the Americas to Zika virus, Plos Neglected Tropical Diseases, 3 mars 2016
Thais Chouin-Carneiro1**, Anubis Vega-Rua2**,#a, Marie Vazeille2, André Yebakima3, Romain Girod4, Daniella Goindin5, Myrielle Dupont-Rouzeyrol6, Ricardo Lourenço-de-Oliveira1, Anna-Bella Failloux2*
1 Instituto Oswaldo Cruz, Rio de Janeiro, Brazil
2 Institut Pasteur, Arboviruses and Insect Vectors, Paris, France
3 Centre de Démoustication/Collectivité Territoriale de La Martinique, Fort-de-France, Martinique
4 Institut Pasteur of French Guiana, Unit of Medical Entomology, Cayenne, French Guiana
5 Institut Pasteur of Guadeloupe, Laboratory of Medical Entomology, Environment and Health, Guadeloupe
6 Institut Pasteur of New Caledonia, Dengue and Arboviruses Research and Expertise Unit, Nouméa, New Caledonia
#a Current address: Institut Pasteur of Guadeloupe, Laboratory of Medical Entomology, Environment and Health, Guadeloupe
* Corresponding author
** These authors contributed equally to this work.