Des scientifiques ont réussi à prédire, à l’échelle de la cellule, l’issue d’une infection par Legionella pneumophila, à l’origine de la légionellose. Pour cela, ils ont combiné analyse du métabolisme, techniques microscopiques de pointe et intelligence artificielle. Cette méthode pourrait être appliquée dans le futur à d’autres bactéries pathogènes.
Comment la légionellose se développe-t-elle dans les stades précoces de l’infection ? Quelles cellules de l’organisme permettent le développement de Legionella pneumophila et pourquoi ? Voici les questions auxquelles ont tenté de répondre plusieurs scientifiques de l’Institut Pasteur.
Legionella pneumophila est la bactérie à l’origine de la majorité des cas de légionellose. Cette maladie se contracte notamment par l’inhalation d’aérosols (gouttelettes d’eau en suspension dans l’air) contaminés. Elle provoque chaque année en France quelques centaines de malades, comme récemment encore dans le secteur d’Albertville en Savoie. La maladie affecte les poumons et peut, dans les situations les plus graves, être mortelle.
Dans quels macrophages la bactérie va-t-elle se multiplier ?
Pour se développer dans l’organisme, Legionella pneumophila détourne une partie de notre système immunitaire. Cette bactérie est ainsi capable d’infecter les macrophages, des cellules immunitaires qui, la plupart du temps, reconnaissent et ingèrent les pathogènes dès leur entrée dans les tissus. Cependant, certains bactéries, comme Legionella pneumophila, ont développé des stratégies pour échapper aux macrophages et les exploiter comme des niches de réplication. Les macrophages, au lieu d’éliminer la bactérie pathogène, deviennent alors au contraire une véritable usine à microbes !
« Mais, parmi les milliers de macrophages infectés par la bactérie, seules certaines cellules laissent vraiment la bactérie se multiplier. » précise Pedro Escoll Guerrero, chercheur dans l’unité Biologie des bactéries intracellulaires à l’Institut Pasteur.
Tout l’enjeu ici est donc de savoir quels sont les macrophages qui permettent à Legionella pneumophila de se multiplier. Pour le déterminer, les scientifiques ont, dans une étude récemment publiée, combiné plusieurs approches telles que l’étude du métabolisme cellulaire, des techniques de microscopie confocale et de l’intelligence artificielle.
Les mitochondries, les éléments-clés pour prédire le futur des cellules infectées
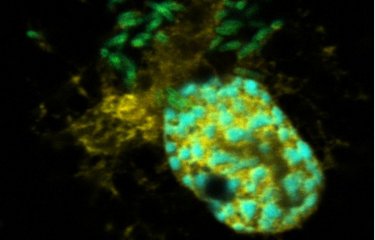
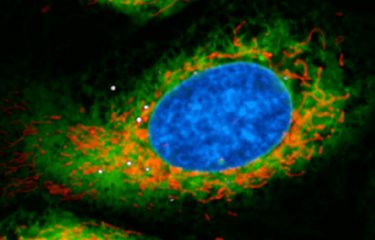
Plusieurs dizaines de milliers de cellules ont été infectées par Legionella pneumophila et filmées en temps réel afin de savoir lesquelles permettaient la multiplication de la bactérie et lesquelles ne le permettaient pas. En parallèle, les scientifiques ont effectué plusieurs mesure au niveau des mitochondries des cellules infectées. De précédents travaux avaient en effet démontré qu’afin de soutenir sa propre réplication, la bactérie manipule les fonctions mitochondriales de la cellule infectée et inhibe le déclenchement de la mort de celle-ci. Le potentiel de membrane mitochondriale, c’est-à-dire la différence de charge électrique entre la matrice et l’espace intermembranaire de la mitochondrie et le taux de mROS, des molécules issues des mitochondries et qui jouent un rôle central dans le métabolisme cellulaire, ont été quantifiés.
« Ce que nous avons découvert c’est que, très tôt après l’infection, les macrophages qui garderont un potentiel de membrane mitochondriale élevé et produiront plus de mROS sont précisément ceux qui permettront ensuite la réplication bactérienne. » détaille Pedro Escoll Guerrero.
Il a ensuite fallu traiter une quantité considérable de mesures métaboliques et d’images, les organiser sous forme de jeux de données chronologiques pour chaque cellule, afin d’alimenter une intelligence artificielle, plus précisément un modèle d’apprentissage automatique. Le modèle mis au point à partir de la trajectoire de plus de 5000 macrophages a ensuite été testé sur près de 1700 cellules. Résultat ? En se basant sur les paramètres mitochondriaux, précocement après l’infection, il est possible de prédire avec une efficacité de 83% si Legionella pneumophila va pouvoir oui ou non se multiplier dans la cellule.
Une méthode applicable à d’autres bactéries pathogènes
La suite ? Tout d’abord, tenter d’optimiser le modèle d’apprentissage automatique afin d’obtenir des prédictions encore plus fiables. Des travaux sont déjà en cours en ce sens. Essayer ensuite d’appliquer la même méthode à d’autres bactéries intracellulaires qui, comme Legionella pneumophila, infectent les macrophages. Par exemple, Salmonella enterica à l’origine de salmonelloses ou Mycobacterium tuberculosis, l’agent pathogène de la tuberculose.
Enfin, ces travaux démontrent que l’analyse à haut débit d’images, en synergie avec de l’intelligence artificielle, permet d’étudier à l’échelle de la cellule individuelle l’hétérogénéité de la réponse à une infection.
Source : Backtracking metabolic dynamics in single cells predicts bacterial replication in human macrophages, Nature communications, 16 octobre 2025
Mariatou Dramé1,4, Francisco-Javier Garcia-Rodriguez1,4, Dmitry Ershov2,3, Jessica E. Martyn1, Jean-Yves Tinevez2, Carmen Buchrieser1,5 & Pedro Escoll1,5
1Institut Pasteur, Université Paris Cité, Biologie des Bactéries Intracellulaires, Paris, France.
2Institut Pasteur, Université Paris Cité, Image Analysis Hub, Paris, France.
3Institut Pasteur, Université Paris Cité, Bioinformatics and Biostatistics Hub, Paris, France.
4These authors contributed equally: Mariatou Dramé, Francisco-Javier Garcia-Rodriguez.
5Corresponding authors : Carmen Buchrieser, Pedro Escoll