Des chercheurs de l'Institut Pasteur et du CNRS viennent de déterminer la structure 3D d'une protéine bactérienne proche du récepteur nicotinique humain, et publient ce résultat dans la revue Nature. C'est un premier pas important pour l'avenir de la modélisation moléculaire de substances capables d'interagir sur ce récepteur et qui pourraient permettre l'aide au sevrage tabagique.
Communiqué de presse
Paris, le 5 novembre 2008
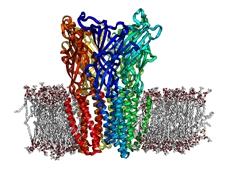
Deux groupes de chercheurs à l’Institut Pasteur, le groupe à 5 ans Récepteurs-canaux dirigé par Pierre-Jean Corringer (1), directeur de recherche au CNRS, et l’unité Dynamique structurale des macromolécules (2) dirigée par Marc Delarue, également directeur de recherche au CNRS, ont déterminé la structure atomique (structure en trois dimensions) d’un homologue du récepteur nicotinique découvert chez une bactérie.
« Cet homologue bactérien a été découvert par génomique comparative. Il dérive d’un ancêtre commun qui aurait entre un et trois milliards d’années, explique Pierre-Jean Corringer. Devant la difficulté à obtenir la structure 3D du récepteur nicotinique humain, nous avons choisi d’établir celle de cette protéine bactérienne, qui n’a pas exactement la même fonction mais est proche de la molécule humaine d’un point de vue purement structural. »
La structure 3D d’un autre homologue bactérien au récepteur nicotinique humain avait déjà été obtenue début 2008 par une autre équipe mais il s’agissait de la structure de la protéine à l’état « inactif », alors que les équipes pasteuriennes ont établi la structure d’une protéine dans un état « actif », c’est à dire le véritable état physiologique. Ils ont ainsi pu comparer les deux structures pour comprendre comment ces récepteurs sont activés par les composés pharmaceutiques.
Ceci va désormais permettre de se rapprocher de la structure 3D du récepteur nicotinique humain et aussi d’avancer dans le champ de la « modélisation moléculaire » ou « drug-design » : il s’agit là de trouver des molécules capables d’interagir avec le récepteur nicotinique, autrement dit des candidats-médicaments pour le sevrage tabagique.
Rappelons que selon l’Organisation mondiale de la Santé, le tabac est la deuxième cause de mortalité dans le monde, et qu’il est actuellement responsable du décès d’un adulte sur dix.
Par ailleurs, les récepteurs bactériens étudiés par les chercheurs sont aussi homologues à d’autres récepteurs humains, en particulier les « GABAA» qui sont la cible des anesthésiques généraux et des anxiolytiques. La structure 3D obtenue par le travail des chercheurs à l’Institut Pasteur pourrait donc également avoir un impact sur le drug-design de ces composés.
__________________
1. URA CNRS 2182
2. URA CNRS 2185
Source
“X-ray structure of a pentameric ligand-gated ion channel in an apparently open conformation” : Nature, publication en ligne le 5 novembre 2008
Nicolas Bocquet (1)*, Hugues Nury (1,2)*, Marc Baaden (4), Chantal Le Poupon (1), Jean-Pierre Changeux (3), Marc Delarue (2) & Pierre-Jean Corringer (1)
1. Institut Pasteur, Groupe à 5 ans Canaux-Récepteurs, CNRS URA 2182, Paris
2. Institut Pasteur, Unit de Dynamique structrale des macromolécules, CNRS URA 2185, Paris
3. Institut Pasteur, CNRS URA 2182, F75015, Paris
4. Institut de Biologie Physico-Chimique, CNRS UPR 9080, Paris, France.
Contacts presse
Service de presse de l’Institut Pasteur
Corinne Jamma ou Nadine Peyrolo – 01 40 61 33 41 – cjamma@pasteur.fr
Bureau de presse du CNRS
01 44 96 51 51 - presse@cnrs-dir.fr