Comprendre les mécanismes qui sous-tendent la mise en place de la polarité des cellules constitue une voie de recherche importante dans l’étude des processus de cancérisation. Le laboratoire Trafic membranaire et division cellulaire, dirigé à l’Institut Pasteur par Arnaud Echard (Institut Pasteur/CNRS UMR 3691), se penche sur les mécanismes d’acquisition de la polarité apico-basale au cours de la division cellulaire, lors la formation des organes. L’équipe vient dans ce cadre de mettre en évidence le rôle clef d’une enzyme de type GTPase, appelée Rab35.
Les épithéliums sont des couches de cellules qui couvrent la surface de notre corps ainsi que les organes internes. Ils forment une véritable barrière et exercent de nombreuses autres fonctions. Ceci est rendu possible par le fait que les cellules composant les épithéliums ne sont pas symétriques, mais s’organisent selon deux pôles opposés. On dit qu’elles s’organisent selon une "polarité apico-basale" avec un pôle apical et un pôle basolatéral. Ces pôles correspondent à des domaines distincts et spécialisés qui permettent le transport de composés de l’intérieur de la cellule vers le milieu extérieur ou vice-versa. Or, la majorité des tumeurs sont issues de tissus épithéliaux, et la perte de polarité est un événement fréquent dans la progression tumorale. Comprendre les mécanismes qui sous-tendent la mise en place de cette polarité constitue donc une voie de recherche importante dans l’étude des processus de cancérisation.
Le laboratoire Trafic membranaire et division cellulaire, dirigé à l’Institut Pasteur par Arnaud Echard (Institut Pasteur/CNRS UMR 3691), se penche sur les mécanismes d’acquisition de la polarité apico-basale au cours de la division cellulaire, lors la formation des organes. L’équipe vient dans ce cadre de mettre en évidence le rôle clef d’une enzyme de type GTPase, appelée Rab35. Sur un modèle in vitro de polarité en 3D, les scientifiques ont montré que les cellules rénales dépourvue de Rab35 présentaient une inversion totale de polarité : le domaine apical occupe l'emplacement du domaine basolatéral et vice-versa. Ils ont en outre pu déterminer que l'emplacement du domaine apical dépendait d’une liaison directe entre Rab35 et une autre protéine apicale, Podocalyxin, déjà connue pour contrôler la polarité et impliquée dans la progression tumorale.
Ces travaux décrivent ainsi un nouveau mécanisme permettant l’établissement d’une polarité normale. En révélant l’implication de Rab35 dans la polarité, ils mettent en évidence comment cette GTPase pourrait participer au processus tumoral et expliquer le pouvoir oncogène de mutations de Rab35 récemment identifiées chez certains patients.
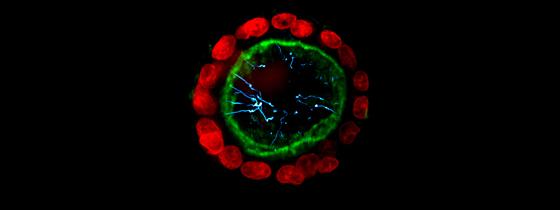
Photo : sphéroïde de cellules rénales cultivées in vitro. En vert, le pôle apical des cellules, et en rouge, leurs noyaux. En bleu, cils primaires ("antennes"), sortant des cellules par leurs pôles apicaux.
Source
Rab35 GTPase couples cell division with initiation of epithelial apico-basal polarity and lumen opening, Nature Communications, 4 avril 2016
Kerstin Klinkert (1,2,3), Murielle Rocancourt (1,2), Anne Houdusse (4) & Arnaud Echard (1,2)
(1) Membrane Traffic and Cell Division Lab, Cell Biology and Infection Department, Institut Pasteur, 25–28 rue du Dr Roux, 75724 Paris, France.
(2) Centre National de la Recherche Scientifique UMR3691, 75015 Paris, France.
(3) Sorbonne Universités, Université Pierre et Marie Curie, Université Paris 06, Institut de formation doctorale, 75252 Paris, France.
(4) Institut Curie, Structural Motility Lab, 26 rue d’Ulm, 75005 Paris, France.
Mis à jour le 04/04/2016





