Les recherches sur le sida, une priorité pour l'Institut Pasteur
Après la découverte du VIH-1 en 1983 par des chercheurs pasteuriens – découverte récompensée en 2008 par le Prix Nobel de médecine –, le sida reste un fléau inacceptable qui affecte tout particulièrement les pays et les populations les plus démunis : 34 millions de personnes vivent avec le VIH/sida dans le monde et, en France, on déplore encore plus de 6000 nouvelles contaminations par an. (voir Le sida en chiffres).
Dans ce contexte, les recherches sur le VIH /sida constituent l’un des objectifs majeurs de l’Institut Pasteur à Paris et du Réseau International des Instituts Pasteur, dans les pays les plus affectés par l’épidémie.
À Paris, une dizaine d’équipes sont mobilisées. Les axes de recherches couvrent la majorité des champs d’investigation prioritaires aujourd’hui. Ils concernent notamment l’étude de l’évolution de l’infection, la variabilité du virus, les mécanismes d’entrée et de multiplication du VIH dans les cellules humaines, la transmission du virus, y compris de la mère à l’enfant, et sa régulation, la physiopathologie de l’infection, la réponse immunitaire de l’homme contre le virus, la protection naturelle chez l’homme, et bien sûr les traitements et les candidats vaccins.
Ces travaux sont réalisés dans le cadre d’un partenariat très étroit avec l’Agence Nationale de Recherche sur le sida et les hépatites virales (ANRS).
La recherche sur le VIH/sida à l'Institut Pasteur
Des avancées remarquables dans la recherche fondamentale et clinique ainsi que dans le traitement et la prévention ont permis en 2012 d’enrayer la montée de la pandémie. Toutefois, Avec plus de 34 millions de personnes infectées dans le monde, et 2,5 millions de nouvelles contaminations chaque année, le sida continue aujourd'hui d'être un problème majeur de santé publique, pour lequel l'effort de recherche doit être maintenu. Il est indispensable de connaître plus finement les mécanismes de l'infection par le VIH, le virus responsable, pour faire avancer, à terme, la recherche thérapeutique et vaccinale. À l'Institut Pasteur, de nombreux travaux sont menés sur les interactions virus-hôte, le traitement de l'infection ou l'étude de candidats-vaccins. Nombre de programmes sont réalisés en liaison avec l'Agence Nationale de Recherches sur le sida et les hépatites virales (ANRS) et en collaboration avec le Réseau International des Instituts Pasteur, certains étant subventionnés par Sidaction.
LE CONTRÔLE DE L'INFECTION ET LA PROTECTION NATURELLE CONTRE LA MALADIE
Le contrôle naturel de la multiplication du VIH
De rares individus infectés par le VIH-1 depuis de nombreuses années, mais qui contrôlent la multiplication du virus, ont été identifiés et sont suivis au sein d’une cohorte de l’Agence nationale de recherches sur le sida et les hépatites virales (ANRS). Ces patients, appelés « contrôleurs du VIH » (HIC), sont séropositifs, infectés depuis plusieurs années, mais n’ont pas de virus détectable dans leur plasma et gardent un taux de cellules T4 élevé. Ils ne développent donc pas de maladie, et contrôlent naturellement l’infection en l’absence de thérapie.
D’importantes avancées dans la compréhension de ce mécanisme de protection ont déjà été réalisées : elles ont permis de mettre notamment en évidence deux facteurs impliqués dans le contrôle de l’infection : des cellules tueuses (T CD8) particulièrement efficaces qui reconnaissent les cellules infectées par le VIH-1 et les suppriment, ainsi qu’une résistance des cellules cibles qui limite leur infection par le VIH (équipe de Gianfranco Pancino).
D’autres travaux indiquent que les lymphocytes CD4 de la « mémoire centrale » jouent un rôle essentiel chez les patients HIC, et expliquent les défenses exceptionnelles de ces patients qui se comportent comme s’ils étaient vaccinés. Ces lymphocytes sont en effet très nombreux chez les contrôleurs du VIH, ils produisent des quantités élevées d’IL-2 ce qui favorise leur multiplication et expriment une molécule de surface leur permettant de rejoindre très facilement les foyers infectieux. Par ailleurs leurs récepteurs spécifiques d’antigène présentent une avidité élevée pour certaines structures virales ce qui leur permet de réagir à la moindre tentative d’échappement du virus (unité d’Immunogénétique cellulaire, dirigée par Jacques Thèze).
Les travaux sur les patients HIC sont menés dans le cadre d’un consortium de laboratoires de recherche mis en place par l’ANRS. Pour la première fois, il est possible d’étudier le système immunitaire organisé pour lutter efficacement contre le virus. Ces travaux devraient influencer le dessin de futures stratégies vaccinales et thérapeutiques.
La protection naturelle contre la maladie
Afin d’identifier des thérapies plus efficaces sur le long terme, et peut-être même d’induire une immunité contre le sida, il est important de comprendre comment les défenses du système immunitaire sont détruites par le VIH. Le VIH induit une inflammation chronique. Celle-ci semble être responsable du sida. Des chercheurs de l’Institut Pasteur ont récemment identifié un marqueur de cette inflammation (groupe de Michaela Muller-Trutwin, unité de Régulation des infections rétrovirales, dirigée par Françoise Barré-Sinoussi). Ils s’intéressent par ailleurs au réservoir animal du VIH, le SIV (virus de l’immunodéficience simienne) présent chez les singes d’Afrique. Les singes verts d’Afrique infectés par le SIV n’évoluent pas vers la maladie sida. Pourquoi ? Contrairement aux hommes infectés par le VIH, les singes d’Afrique ne présentent pas d’inflammation chronique, et leurs cellules T4 ne disparaissent pas anormalement. Des travaux récents montrent que les singes d’Afrique sont capables d’inhiber l’inflammation induite par le virus. Des études sont en cours pour identifier le mécanisme d’inhibition. Comprendre les mécanismes à l’origine de cette inhibition pourrait permettre de trouver des parades contre le sida chez l’homme.
Le contrôle de la transmission du VIH-1 au niveau des muqueuses
Les muqueuses sont les sites privilégiés pour l'entrée du virus dans l'organisme. Afin de mieux comprendre les mécanismes impliqués dans le contrôle de l’infection au niveau des muqueuses, des chercheurs se concentrent sur l’étude du contrôle naturel de la transmission in utero du virus de la mère à l’enfant (équipe d’Elisabeth Menu, de l’unité de Régulation des infections rétrovirales, dirigée par Françoise Barré-Sinoussi). Au cours de la grossesse, 90% des enfants de femmes VIH-1 positive sont naturellement protégés de l’infection par le virus. Les chercheurs ont montré que le placenta et son environnement joue un rôle important dans cette protection. Actuellement, ils s’intéressent plus particulièrement au rôle dans ce contrôle de l’immunité innée maternelle au niveau de la muqueuse utérine pendant la grossesse. En parallèle, ils développent un projet sur le rôle de l’immunité innée dans le contrôle de l’infection au niveau des muqueuses du tractus génital chez la femme. L’ensemble de ces travaux pourrait aboutir à l’identification de nouveaux mécanismes de défense contre des pathogènes au niveau des barrières que sont les muqueuses. Ceci pourrait conduire à l'élaboration de nouvelles stratégies de prévention de la transmission basées sur la stimulation de l'immunité innée.
LA PHYSIOPATHOLOGIE DE L'INFECTION ET LES MÉCANISMES DE L'IMMUNODÉFICIENCE
De nombreuses analyses sont faites chez l’animal et chez l’homme (suivi de sujets séropositifs) pour comprendre comment le système immunitaire est déréglé et en grande partie détruit au cours de l’infection.
Le système immunitaire anormalement suractivé
Chez les patients infectés par le VIH, l’unité d’Immunologénétique cellulaire, dirigée par Jacques Thèze, a montré que le système immunitaire était anormalement suractivé : les lymphocytes CD4 apparaissent comme désensibilisés et ne répondent plus aux signaux normaux donnés par les molécules messagères du système immunitaire, comme les interleukines IL-2 et l’IL-7 notamment. Les mécanismes cellulaires et moléculaires permettant de lier l’activation anormale et la non réponse à ces cytokines ont été décrits : ils mettent en jeu un blocage des voies de transduction des signaux au niveau membranaire. La non-réponse à l’IL-2 rend compte de l’incapacité des lymphocytes CD4 à réagir contre le virus alors que la non-réponse à l’IL-7 explique la diminution du nombre de CD4. La correction partielle de ces défauts par les traitements antirétroviraux permet aussi de comprendre la reconstitution incomplète du système immunitaire après le traitement.
Le rôle des cellules T régulatrices
L’activation chronique du système immunitaire est associée à la progression de la maladie provoquée par le VIH et à la survenue de complications associées telles que des complications cardiovasculaires ou un risque accru de cancer. D’autres recherches se focalisent ainsi sur l’étude du rôle de différentes populations des cellules T régulatrices dans le contrôle de l’activation chronique du système immunitaire lors de l’infection par le VIH (Laurence Weiss, dans l’unité dirigée par Françoise Barré-Sinoussi). Cette étude est menée en collaboration avec l’Assistance publique – Hôpitaux de Paris.
Le virus perturbe les contacts entre les cellules du système immunitaire
Des chercheurs ont en outre découvert un mécanisme par lequel le virus du sida altère la réponse immunitaire (unité de Biologie cellulaire des lymphocytes, dirigée par Andrès Alcover et unité Virus et immunité d’Olivier Schwartz). Les scientifiques ont montré que l’infection des lymphocytes T par le virus perturbait des contacts cellulaires entre ces lymphocytes T et d’autres cellules du système immunitaire. Ces contacts, appelés « synapses immunes », sont indispensables au déclenchement des réponses immunitaires.
Des cellules infectées moins mobiles
L’équipe d’Olivier Schwartz (unité Virus et immunité) étudie également les effets de l’infection sur la forme et la mobilité naturelle des cellules. Les lymphocytes émettent normalement des extensions, ou voiles membranaires, qui leur permettent de se déplacer dans l’organisme. Les cellules infectées par le VIH émettent moins de voiles, et sont moins mobiles, ce qui contribuerait à perturber le système immunitaire et à augmenter sa multiplication.
LES MÉCANISMES DE L'INFECTION PAR LE VIH : ENTRÉE, MULTIPLICATION ET DISSÉMINATION DANS LES CELLULES HUMAINES
Plusieurs équipes ont pour objectif de décrypter les mécanismes d’entrée du virus dans les cellules cibles, de son intégration au patrimoine génétique de la cellule, la façon dont il détourne la machinerie cellulaire pour « se faire produire » par la cellule qu’il infecte, les mécanismes de défense des cellules cibles contre l’infection, etc.
Suivre la dynamique de l’infection
Les mécanismes moléculaires impliqués dans l'infection et la dissémination du virus dans l’organisme, ainsi que la réponse du système immunitaire face à cette infection sont étudiés (unité Virus et immunité, dirigée par Olivier Schwartz). Ces travaux concernent notamment les mécanismes du passage du VIH d'une cellule à l'autre - passage qui est le mode privilégié de propagation du virus - ou encore les barrières de défense antivirale mises en place par la cellule elle-même. La multiplication virale en culture cellulaire est maintenant suivie en temps réel, par vidéomicroscopie, en utilisant des virus fluorescents. Ces techniques apportent des informations importantes sur la dynamique de l’infection, et sur les interactions entre les cellules infectées et le système immunitaire.
L’équipe d’Olivier Schwartz étudie également les mécanismes de reconnaissance par le système immunitaire des cellules infectées. Ces travaux visent à mieux comprendre comment et pourquoi le système immunitaire réagit de façon excessive, et déclenche une réaction inflammatoire néfaste pour l’organisme.
L’étude des récepteurs cellulaires au virus
Par ailleurs, des recherches sont menées sur les récepteurs du virus, leur distribution à la surface de la membrane cellulaire, leur organisation et les interactions avec les protéines de l’enveloppe virale qui modifient l’environnement des lymphocytes T CD4, permettant au virus d’initier son cycle de réplication (unité d'Immunologie virale, dirigée par Fernando Arenzana-Seisdedos).
Bloquer la réplication du virus
L’équipe de Gianfranco Pancino, dans l'unité de Régulation des infections rétrovirales dirigée par Françoise Barré-Sinoussi, a révélé que l’activation par certains stimuli des macrophages, cible majeure, avec les lymphocytes T CD4, de l’infection au VIH-1, bloque la multiplication du virus en lui empêchant d’établir une infection persistante. Les chercheurs ont identifié une molécule cellulaire, appelée p21, responsable de cette inhibition. L’équipe d'Elisabeth Menu, dans la même unité, travaille sur les mécanismes de restriction de l'infection dans les cellules trophoblastiques du placenta, des cellules humaines naturellement résistantes au VIH-1. Ces cellules pourraient contribuer au contrôle de la transmission du VIH-1 in utero de la mère à l’enfant.
Un dialogue entre cellules de l’immunité favorable à la multiplication du virus ?
L'unité Immunité anti-virale, biothérapie et Vaccins, dirigée par Marie-Lise Gougeon, étudie en outre le dialogue entre les cellules Natural Killer (NK) et les cellules dendritiques (CD), cibles du virus. L'équipe a récemment montré que l'interaction entre les deux types de cellules permettait au virus de se multiplier fortement au sein des cellules dendritiques, et de détourner ces cellules pour en faire des « réservoirs » viraux. Les chercheurs ont en outre prouvé que les cellules dendritiques infectées deviennent résistantes à l'activité tueuse des cellules NK, car elles surexpriment des molécules bloquant les processus de mort cellulaire. HMGB1, une alarmine impliquée dans l’alerte du système immunitaire après l’entrée d’un pathogène, et essentielle au dialogue entre cellules NK et CD, s’est avérée être responsable de l’augmentation de la réplication virale dans les CD et de leur état de résistance à l’activité tueuse des cellules NK. Les chercheurs ont aussi montré que la concentration de HMGB1 circulante est élevée chez des patients infectés par le VIH, et cette alarmine est un marqueur de survenue de troubles neurologiques pouvant se déclencher lors de cette infection.
D’autres chercheurs (équipe de Daniel Scott-Algara (unité de Régulation des infections rétrovirales, dirigée par Françoise Barré-Sinoussi) ont par ailleurs identifié une population de cellules NK capable de contrôler, in vitro, la réplication du VIH dans les cellules dendritiques. Cette question critique concernant le rôle des lymphocytes NK dans l’immunité naturelle contre le virus constitue un champ de recherche très actif à l’Institut Pasteur.
L'AMÉLIORATION DES THÉRAPIES
Restaurer les défenses immunitaires des patients
Les antirétroviraux permettent de contrôler la multiplication du VIH mais ne restaurent que très peu les réponses anti-VIH. Ces thérapies doivent en outre être prises à vie avec des effets indésirables parfois lourds et un certain nombre d’échecs thérapeutiques. L’unité d’Immunogénétique Cellulaire, dirigée par Jacques Thèze, collabore à des essais pré-cliniques ou cliniques, menés par l’ANRS, utilisant des molécules du système immunitaire (IL-2 et IL-7) pour tenter de restaurer les défenses des patients, altérées par l’infection. L’objectif est de mieux définir l’utilisation de ces molécules comme médicaments susceptibles de rétablir chez les patients la réponse immunitaire spécifique au VIH. La recherche de mimétiques de ces cytokines avec des effets secondaires diminués est en cours (équipe de Thierry Rose, unité d’Immunogénétique cellulaire dirigée par Jacques Thèze)
Contrôler l’entrée du VIH dans les cellules cibles
Un travail collaboratif soutenu par l’ANRS entre des équipes de l’Institut Pasteur (Françoise Baleux dans l’unité de Chimie des Biomolécules, dirigée par Laurence Mulard), du CEA, du CNRS et des Universités Joseph Fourier et Paris-Sud 11 a permis en 2009 de développer une molécule capable de bloquer l’entrée du VIH dans ses cellules cibles. Cette nouvelle construction moléculaire originale, associant un sucre et un peptide, présente l’avantage d’agir bien avant que le virus ne se réplique à l’intérieur de la cellule. Une version entièrement synthétique et miniaturisée de ce composé a pu être produite et son mécanisme d’action déterminé. Le mode d’action de ce glycopeptide obtenu par synthèse chimique a été déterminé, validant ainsi le concept d’inhibiteur d’entrée bi-fonctionnel. Les chercheurs ont depuis travaillent à présent à développé des analogues de cette tête de série, tout aussi efficaces mais plus faciles à produire. La prochaine étape consistera en la réalisation de tests in vivo sur ces inhibiteurs du VIH de seconde génération (ANR).
Induire un contrôle permanent de l’infection
On ne peut pas interrompre la thérapie antirétrovirale chez des patients traités en phase chronique sous peine d’une réactivation du virus. Des patients traités très précocement après l’infection et qui continuent à contrôler le virus après interruption de la thérapie ont été récemment identifiés. Des recherches sur ces patients ont été entreprises dans le cadre de l’étude VISCONTI de l’ANRS afin de déterminer les paramètres qui peuvent conduire à une rémission permanente (équipe de Gianfranco Pancino dans l’unité de Régulation des infections rétrovirales, dirigée par Françoise Barré-Sinoussi).
LES ESPOIRS DE LA RECHERCHE VACCINALE
Un candidat-vaccin à l’essai chez l’homme
Un candidat-vaccin « VIH-rougeole », mis au point ces dernières années à l’Institut Pasteur (laboratoire de Génomique virale et vaccination, dirigé par Frédéric Tangy) a été testé chez l’homme en 2010-2011. Cet essai de phase I a permis de démontrer l’innocuité du vaccin chez des adultes. Son immunogénicité est en cours d ‘étude. L’objectif du projet est de faire un vaccin dit « recombinant », c’est-à-dire d’introduire deux à trois gènes du VIH dans le génome du virus atténué de la rougeole, qui a depuis longtemps prouvé son innocuité et son efficacité en temps que vaccin humain. Un tel vaccin combiné permettrait donc de protéger à la fois contre le sida et la rougeole.
Un nouveau vecteur vaccinal très prometteur
Des chercheurs de l’Institut Pasteur et du CNRS (unité Virologie Moléculaire et Vaccinologie, dirigé par Pierre Charneau) ont obtenu en 2009 des résultats très prometteurs d’essais pré-cliniques destinés à tester une nouvelle technologie vaccinale anti-sida. Celle-ci s’appuie sur l’utilisation d’un nouveau vecteur appelé vecteur lentiviral, capable de délivrer l’ADN vaccinal au cœur du noyau des cellules du système immunitaire. Ces travaux ont servi de point de départ pour optimiser le candidat vaccin, qui montre maintenant une protection très accrue contre l’infection. Un essai chez les patients VIH+ de vaccination thérapeutique, dont le but est de conférer une protection immune naturelle sans polythérapie, est en cours. Les premiers résultats seront disponibles fin 2013.
--
Le Groupe de Réflexion Sida de l’Institut Pasteur a pour objectifs de mener une réflexion commune et d’organiser l’échange d’informations sur le thème VIH/sida au sein du campus pasteurien. Il assure une information, établit des interactions concrètes avec les cliniciens hospitaliers et les chercheurs du Réseau International des Instituts Pasteur, et promeut des actions de recherche et de santé publique.
VIH et sida dans le Réseau International des Instituts Pasteur
Les établissements du Réseau International des Instituts Pasteur (RIIP) sont fortement impliqués dans les travaux sur le virus du sida et sur la maladie elle-même. L'implantation des instituts du Réseau, notamment en Afrique et en Asie du Sud-Est, est particulièrement importante quand on sait que plus de 90 % des cas de sida se trouvent au Sud.
CAMEROUN
Améliorer le diagnostic et la prise en charge précoces du VIH chez les nouveaux-nés
Le projet ANRS 12140-PEDIACAM mené au Centre Pasteur du Cameroun a pour objectifs d’évaluer la faisabilité, la tolérance et l’efficacité, dans le contexte camerounais, des multithérapies anti-rétrovirales précoces chez les nourrissons infectés par le VIH. Cette étude débutée en novembre 2007, a montré que l’application des recommandations de l’OMS en matière de prévention de la transmission de la mère à l’enfant du VIH dans le contexte opérationnel d’un pays à ressources limitées est faisable et efficace (1). En parallèle, un soutien de la Fondation Total permet d’améliorer les conditions de prise en charge médicale et psycho-sociale des enfants infectés par le VIH dans les sites où se déroule l’étude PEDIACAM.
Evaluer la réponse au vaccin rougeole des nouveau-nés infectés par le VIH
Le projet ANRS 12207 – PRIVAR mené par le Centre Pasteur du Cameroun et associé au projet PEDIACAM, vise à étudier la réponse vaccinale chez des enfants infectés ou non par le VIH. L’objectif est de déterminer si les nouveau-nés infectés par le VIH sont capables de développer et de maintenir une réponse immunitaire notamment à médiation cellulaire contre la rougeole et quelles sont les populations de cellules immunitaires mobilisées chez ces enfants lors de la vaccination. A terme, ce type d’évaluation peut permettre d'identifier d’éventuels indicateurs d’échec de la vaccination chez les enfants VIH+ et de proposer si nécessaire une adaptation du calendrier vaccinal.
CAMBODGE
Améliorer la prise en charge des patients co-infectés par le VIH et la tuberculose
L’essai clinique CAMELIA, soutenu par l’ANRS et le NIH, auxquels étaient associés les Instituts Pasteur du Cambodge et de Paris, a été mené chez des patients tuberculeux co-infectés par le VIH, présentant un très faible taux de lymphocytes CD4+. Il a démontré qu’une introduction précoce des ARV, 15 jours après le démarrage des anti-tuberculeux (anti-TB), réduisait de 34% le risque de décès chez ces patients à un stade avancé de l’infection VIH, ouvrant la voie à une prise en charge optimale de la co-infection la plus répandue et la plus meurtrière dans les pays en développement (2).
À cet essai, sont associés des projets de recherche plus fondamentaux qui s’intéressent à l’immunopathogénèse de syndrome inflammatoire de reconstitution immunitaire (IRIS). En effet, chez des patients co-infectés VIH/TB et traités pour ces deux infections, la restauration très rapide d’une réponse immunitaire, peut engendrer une réaction paradoxale, pouvant être fatale, appelée syndrome inflammatoire de reconstitution immunitaire (IRIS). Les IRIS sont décelés sur la constatation d’une aggravation des symptômes cliniques des patients et il n’existe pas encore de marqueurs prédictifs ou de test diagnostic. Les équipes de recherche de l’Institut Pasteur de Paris et du Cambodge, ont montré, qu’en l’absence de traitement antirétroviral, il existe une corrélation entre l’activité des cellules tueuses naturelles (NK) et le risque de déclenchement d’une réaction paradoxale (3). Elles travaillent à présent au développement d’un test pronostic du développement d’IRIS qui devrait permettre d’améliorer la prise en charge des patients et une meilleure gestion du moment d’introduction des antirétroviraux. Ces travaux, qui viennent d’être publiés, vont se poursuivre avec deux études en collaboration avec le Brésil qui vont permettre d’une part de confirmer ces résultats sur une population génétiquement différente de celle du Cambodge et mieux caractériser la réponse des cellules NK chez les patients co-infectés.
CHINE
Vaccination & tumeurs associées au VIH
A l’Institut Pasteur de Shanghai, une équipe de recherche travaille sur des approches innovantes de vaccination contre l’infection VIH. Ses travaux se concentrent notamment sur le développement de nouveaux immunogènes et de nouveaux sites de fixation d’anticorps neutralisants sur l’enveloppe virale.
Une autre équipe étudie les mécanismes de latence par lesquels l’herpèsvirus HHV-8 établit et maintient une infection au long cours. Ce virus est le principal agent responsable des sarcomes de Kaposi et des lymphomes primaire d’effusion notamment chez les patients en stade SIDA.
VIÊT NAM
Substitution par la méthadone chez les usagers de drogue par voie veineuse
Substitution par la méthadone chez les usagers de drogue par voie veineuse - Viêt-Nam L’épidémie de VIH au Viêt-Nam touche essentiellement des personnes s’injectant des drogues et des prostituées. Depuis 2007, le gouvernement vietnamien a approuvé l’usage de la méthadone comme traitement de substitution de l’héroïne. Des programmes pilote de substitution par la méthadone ont été mis en place à Hai Phong et Ho Chi Minh Ville. L’objectif d’un projet pilote mené par les Instituts Pasteur à Paris et à Ho Chi Minh, a été d’étudier les principales caractéristiques des patients pris en charge dans ces deux centres de substitution et d’évaluer s’il était possible d’établir une cohorte d’usagers de drogue fréquentant ces centres. L’établissement de cette cohorte est désormais envisagé. Elle pourra, en relation avec ESTHER pour le volet opérationnel, faciliter la mise en place de recherches concernant l’amélioration de la prise en charge de ces patients.
Par ailleurs, en termes de santé publique, la vaste majorité des Instituts Pasteur du réseau en Afrique et en Asie du Sud-Est réalise le diagnostic sérologique et moléculaire de l’infection VIH et le suivi immunologique (taux de lymphocytes T CD4+) et virologique (charge virale et résistance aux ARV) des patients traités ou non par des ARV.
(1) Tejiokem MC et al, Feasibility of early infant diagnosis of HIV in resource-limited settings: the ANRS 12140-PEDIACAM study in Cameroon. PLoS One. 2011;6(7):e21840. Epub 2011 Jul 19
(2) Blanc FX et al, CAMELIA (ANRS 1295–CIPRA KH001) Study Team. Earlier versus later start of antiretroviral therapy in HIV-infected adults with tuberculosis. N Engl J Med. 2011 Oct 20;365(16):1471-81.
(3) Pean P et al Cambodian Early versus Late Introduction of Antiretroviral Drugs (CAMELIA) study team. Natural killer cell degranulation capacity predicts early onset of the immune reconstitution inflammatory syndrome (IRIS) in HIV-infected patients with tuberculosis. Blood. 2012 Apr 5;119(14):3315-20.
Le sida en chiffres
DANS LE MONDE
Source : rapport ONUSIDA, novembre 2012
Nombre de personnes vivant avec le VIH/SIDA dans le monde en 2011 : 34 millions
Nombre de nouveaux cas d’infection à VIH en 2011 : 2,5 millions
Nombre de décès dus au sida en 2011 : 1,7 millions
|
|
Nombres de personnes vivant avec le VIH/sida en 2011 |
Nombres de nouvelles contaminations par le VIH en 2011 |
Nombre de décès dus au VIH/sida en 2011 |
|
Afrique sub-saharienne |
23,5 millions |
1,8 millions |
1,2 millions |
|
Afrique du Nord et Moyen Orient |
300 000 |
37 000 |
23 000 |
|
Asie du Sud et du Sud-Est |
4 millions |
280 000 |
250 000 |
|
Asie de l’Est |
830 000 |
89 000 |
59 000 |
|
Amérique Latine |
1,4 millions |
83 000 |
54 000 |
|
Caraïbes |
230 000 |
13 000 |
10 000 |
|
Europe orientale et Asie centrale |
1,4 millions |
140 000 |
92 000 |
|
Europe occidentale et centrale |
900 000 |
30 000 |
7000 |
|
Amérique du Nord |
1,4 millions |
51 000 |
21 000 |
|
Océanie |
57 000 |
4 500 |
1 400 |
|
Total |
34 millions |
2,5 millions |
1,7 millions |
EN FRANCE
En France, en 2009, 150 000 personnes, dont 48 000 femmes, vivaient avec le VIH/sida.
68 000 personnes se sont contaminées en 2009. Le virus a causé 1700 décès.
La transmission au sein de la population homosexuelle masculine continue d'être particulièrement élevée, comme dans toute l'Europe et en Amérique du Nord.
POUR EN SAVOIR PLUS
> Lire le rapport de l'Onusida
2008 : deux prix Nobel pour la découverte du virus du sida
En 2008, les Professeurs Françoise Barré-Sinoussi et Luc Montagnier ont reçu le prix Nobel de médecine 2008 pour leurs travaux portant sur la découverte du rétrovirus responsable du sida en 1983 à l'Institut Pasteur.
Vingt-cinq ans après l’isolement du virus du sida, ce prix est venu reconnaître le travail des scientifiques, et à travers eux celui de leurs collaborateurs cliniciens et chercheurs. Cette distinction devra encourager les jeunes à répondre aux nombreuses questions non résolues, comme le vaccin, le contrôle du virus et les nouveaux outils de prévention.
FRANÇOISE BARRÉ-SINOUSSI
Françoise Barré-Sinoussi Françoise Barré-Sinoussi est Professeur de classe exceptionnelle à l’Institut Pasteur et Directrice de recherche Inserm de classe exceptionnelle. Elle dirige l’unité Régulation des Infections Rétrovirales à l’Institut Pasteur. Elle est également Présidente du Conseil scientifique de l’ANRS, coordinatrice du site de recherche de l’ANRS en Asie du Sud-Est et Présidente de la Société Internationale du sida (IAS). Françoise Barré-Sinoussi a établi de nombreuses collaborations avec les pays les plus touchés par l’épidémie de VIH/sida, notamment à travers le Réseau International des Instituts Pasteur. Ses travaux ont donné lieu plus de 270 publications originales dans des revues scientifiques internationales, à plus de 250 communications lors de congrès internationaux et à 17 dépôts de brevets.
Les recherches menées au sein de son unité visent à mieux comprendre quelles sont les réponses immunitaires innées et adaptative qu’il est nécessaire d’induire pour contrôler soit l’infection VIH elle-même soit l’activation immunitaire anormale et délétère qu’elle induit.
LUC MONTAGNIER
Luc Montagnier est Professeur Emérite à l’Institut Pasteur, où il a dirigé, de 1972 à 2000, l’Unité d’Oncologie Virale, Directeur de Recherches Emérite au CNRS et membre des Académies des Sciences et de Médecine.
Il est actuellement Président de la Fondation Mondiale Recherche et Prévention SIDA, créé en 1993 avec Federico Mayor, ancien Directeur Général de l’UNESCO.
La découverte du virus du sida en 1983
Les premiers cas de sida ont été décrits aux Etats-Unis, en 1981. On ne parlait alors pas encore de sida (syndrome d’immunodéficience acquise) pour décrire ce nouveau syndrome inexpliqué, mais plutôt de « gay syndrome », car il fut initialement identifié chez des homosexuels.
Courant 1982, les médecins français commencent à se mobiliser, avec l'apparition en France de cas similaires. Un certain nombre de recherches avaient été entreprises au niveau mondial depuis la première description de cette maladie chez des homosexuels, observée par la suite chez des hémophiles transfusés, ce qui laissait soupçonner que l'agent infectieux en cause était un virus.
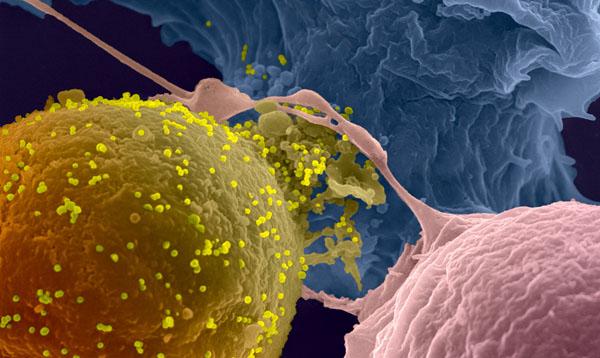
En 1982, après avoir essayé en vain d’assimiler ce supposé virus à tous ceux connus jusqu’alors, Willy Rozenbaum, clinicien français travaillant à l’Hôpital Bichat, est certain de se trouver devant un virus d’un tout nouveau genre. À cette époque, il vient à l’Hôpital Pasteur donner une conférence sur ce nouveau syndrome d’immunodéficience, espérant par la même occasion convaincre des virologistes de l’Institut Pasteur de venir travailler avec lui sur cette infection d'origine inconnue. Mais personne ne répond à son appel.
Françoise Brun-Vezinet, qui travaille avec lui en tant que médecin-virologue, lui propose alors de contacter les enseignants du cours de rétrovirologie qu’elle a suivi à l’Institut Pasteur : Jean-Claude Chermann, avec lequel Françoise Barré-Sinoussi travaillait à l'époque comme chercheur Inserm, et Luc Montagnier. Leurs recherches au sein de l'unité d'Oncologie virale (Institut Pasteur – CNRS - Inserm) concernaient les relations rétrovirus-cancers. Luc Montagnier accepte d’aider Willy Rozenbaum et demande à Jean-Claude Chermann et à Françoise Barré-Sinoussi s’ils sont prêts à s’impliquer dans la recherche de l'agent responsable de cette maladie nouvellement identifiée. Comme ils disposaient alors d’un certain nombre de technologies pour travailler sur les rétrovirus et que certains de ces rétrovirus, chez le chat notamment, étaient connus pour provoquer une immunodéficience, les deux scientifiques acceptent.
L’Institut Pasteur se lance donc dans l’aventure fin 1982. Une première réunion a lieu à l'Institut Pasteur en décembre 1982 avec, entre autres, Willy Rozenbaum et Françoise Brun-Vezinet, pour discuter des recherches à entreprendre. En janvier 1983, Willy Rozenbaum envoie la première biopsie ganglionnaire d’un patient atteint de « lymphadénopathie généralisée », c’est-à-dire au stade de « pré-sida » (avant l'apparition d'une immunodéficience profonde), prélevée à l’hôpital Pitié-Salpetrière.
C’était ce que l’équipe pasteurienne souhaitait car elle savait déjà que les patients qui développaient la maladie voyaient leur taux de lymphocytes CD4 tomber en flèche jusqu’à disparaître quasi complètement. L’équipe supposait donc que ces cellules CD4 étaient la cible du virus inconnu et qu’il fallait, pour l’isoler, qu'elles soient encore présentes dans le prélèvement ganglionnaire. Luc Montagnier mit alors en culture les cellules ganglionnaires issues de la biopsie, puis apporta régulièrement à Françoise Barré-Sinoussi et Jean-Claude Chermann le surnageant de culture pour rechercher la présence de rétrovirus, notamment par la détection d’une activité transcriptase inverse. Environ trois semaines plus tard, une telle activité fut effectivement détectée, mais un phénomène de mort cellulaire fut observé de façon concomitante. Ce fut un moment d'inquiétude, car il y avait un risque de perdre immédiatement le virus qui venait pour la première fois d’être détecté !
Au cours d'une réunion organisée en toute urgence, l’équipe pasteurienne décida de prendre des globules blancs de donneurs de sang (l’Hôpital Pasteur disposait alors d’un centre de transfusion sanguine) pour les réinjecter immédiatement dans la culture : l’activité enzymatique rétrovirale fut à nouveau détectée et à nouveau encore cette détection fut suivie d'un phénomène de mort cellulaire… C’était, en fait, la première observation de l’effet cytopathogène du virus.
Charlie Dauguet, responsable à l'époque de la microscopie électronique au sein de l'unité d'Oncologie virale, se vit confier le soin de rechercher dans la culture de cellules dans laquelle une activité enzymatique rétrovirale était détectée, des particules virales de type rétrovirus. Il lui fallut beaucoup de patience, mais il finit, au bout de quelques jours, par observer ce virus sous son microscope.
Une fois le virus détecté, il fallait le caractériser. Les chercheurs de l’unité d’Oncologie virale ont alors fait appel à l’équipe américaine du Pr Gallo (National Cancer Institute, Etats-Unis) qui avait décrit le seul rétrovirus humain connu à l'époque, le HTLV 1. Le Pr Gallo les informa qu'il était lui aussi à la recherche du virus responsable de ce que l’on allait appeler sida et pensait qu'il s'agissait du HTLV 1 (Human T-Cell Leukemia Virus), virus associé à une maladie rare – une leucémie des lymphocytes T – qu’il avait découvert en 1980. Mais les premières comparaisons effectuées, notamment par immunofluorescence par Marie-Thérèse Nugeyre et confirmées par la suite, suggéraient qu'il n'en était rien.
C’est ainsi que fût publiée en mai 1983 dans la revue Science*, la première description du virus responsable du sida, que l’équipe à l’Institut Pasteur avait appelé à l'époque «Lymphadenopathy Associated Virus » ou LAV. Le lien de causalité entre ce virus et le sida restait encore en effet à démontrer.

À l’Institut Pasteur, le laboratoire reçoit d’autres échantillons de patients au stade de pré-sida ou même de sida avéré. La collaboration avec les virologistes hospitaliers (Françoise Brun-Vezinet et Christine Rouzioux, Hôpital Bichat) se développe pour mettre au point des tests de diagnostic sérologique chez des patients infectés. Ce sont ces tests qui seront commercialisés en 1985.
La collaboration s’étend bientôt à des immunologistes hospitaliers (Jean-Claude Gluckman et David Klatzman, Pitié-Salpétrière) et des cliniciens, comme le Dr Vilmer (hôpital Necker), ce qui permet, au cours de l’année 1983, de démontrer que les lymphocytes T CD4 sont la cible majeure du virus, et qu'ils en meurent.
L‘équipe prend également contact avec des biologistes moléculaires (Simon Wain-Hobson, Pierre Sonigo, Marc Alizon, entre autres) pour analyser le génome de ce virus : leurs travaux aboutiront, un peu plus tard, à la description de la séquence du virus.
Plus tard dans l’année 1983, les scientifiques de l’unité d’Oncologie virale apportent la preuve qu’il s’agit bien d’un rétrovirus, ce que certains contestaient à l'époque.
La caractérisation des protéines constituant le virus est également entreprise dès 1983. L’analyse des protéines du virus montrera également que le LAV était totalement différent des « candidats » américains, les virus HTLV-1 et HTLV-2.
Enfin, au cours de cette même année, une collaboration entreprise avec le CDC à Atlanta, permit, par des études sur des sérums provenant de patients américains et français, de renforcer l’hypothèse du lien entre le virus et la maladie sida, en démontrant une corrélation entre la présence d’anticorps chez les malades et celle du virus.
C'est également avec le CDC que furent entrepris les premiers travaux démontrant la transmission possible du virus chez des chimpanzés.
Si toutes ces découvertes ont pu se faire si vite, c’est grâce à une interaction tout à fait exemplaire entre experts de disciplines distinctes et complémentaires - cliniciens, virologistes, immunologistes, biologistes moléculaires, épidémiologistes (Jean-Baptiste Brunet) - issus à la fois du monde de la recherche fondamentale et du milieu hospitalier.
* Isolation of a T-Lymphotropic Retrovirus from a Patient at Risk for Acquired Immune Deficiency Syndrome ( AIDS), Science , 220, 868-871 (1983)
F. Barré-Sinoussi1, J.C. Chermann1, F. Rey1, M.T. Nugeyre1, S. Chamaret1, J. Gruest1, C. Dauguet1, C. Axler-Blin1, F. Vézinet-Brun2, C. Rouzioux2, W. Rozenbaum3, L. Montagnier1.
1- Département de Virologie, Institut Pasteur
2- Laboratoire Central-Virologie, Hôpital Claude Bernard
3- Département de Santé publique et Médecine tropicale, Hôpital La Pitié-Salpétrière
Fin 1983, la preuve était donc faite : le virus LAV (appelé par la suite VIH-1), rétrovirus humain, était bien l’agent du sida.
En janvier 1985, paraît dans la revue Cell un article sur le séquençage du virus LAV. Celui-ci a été effectué par :
- Simon Wain-Hobson, alors au sein de l’unité Recombinaison et expression génétique (Pasteur – Inserm – CNRS), responsable de l’équipe ;
- Pierre Sonigo, dans la même unité ;
- Olivier Danos, alors au sein de l’unité des Virus oncogènes (Pasteur – CNRS) ;
- Stewart Cole, alors au sein du G3, Groupement Génie Génétique à l’Institut Pasteur ;
- Marc Alizon, alors au sein de l’unité d’Oncologie virale (Pasteur - CNRS – Inserm).
La même année, Diagnostics Pasteur, à la suite des travaux effectués par les équipes pasteuriennes, mettra au point un premier test de dépistage du VIH-1, Elavia.
En 1985 toujours, l’unité d’Oncologie virale isolera un second virus du sida, le LAV-2 (futur VIH-2), à partir d’un prélèvement effectué sur un malade originaire d’Afrique de l’Ouest, hospitalisé au Portugal (Luc Montagnier, Denise Guétard et François Clavel, à l’Institut Pasteur en collaboration avec des médecins portugais de l’hôpital Egas Moniz à Lisbonne, ainsi qu’avec des virologistes et des médecins de l’hôpital Claude Bernard).
La séquence de ce second virus sera publiée en 1987 dans Nature (collaboration à l’Institut Pasteur entre les unités d’Oncologie virale, de Recombinaison et Expression génétique, et le laboratoire de Biologie moléculaire et Immunologie des Rétrovirus ; auteurs : M. Guyader, M. Emerman, P. Sonigo, F. Clavel, L. Montagnier, M. Alizon).
En 1987, un test de dépistage spécifique au VIH-2, sera mis au point par Diagnostics Pasteur. Des collaborations seront entreprises notamment avec Genetic Systems.


