Diabète de type 1, sclérose en plaques, polyarthrite rhumatoïde, spondylarthrite ankylosante, psoriasis, lupus érythémateux disséminé, vitiligo, maladie de Crohn, syndrome de Guillain-Barré… Ces maladies apparemment bien différentes ont un point commun : elles sont dues à un dérèglement du système immunitaire qui se met à "attaquer" l'organisme qu'il doit normalement protéger. Appelées maladies « auto-immunes », elles touchent environ 5 millions de personnes en France et constituent le troisième groupe de maladies en terme de morbidité et de mortalité dans les pays industrialisés, après les cancers et les maladies cardiovasculaires. Aujourd’hui, si des traitements permettent de freiner leur évolution, elles restent inguérissables.
Le « soi » devient l’ennemi
Véritable armée intérieure constituée de plusieurs types de « globules blancs », le système immunitaire défend l’organisme des agressions extérieures, comme les bactéries ou les virus, et tolère habituellement ses propres constituants - le « soi ». Quand la tolérance au soi se rompt, il devient source de maladie. Certains globules blancs (des « lymphocytes auto-réactifs ») s’attaquent spécifiquement à des tissus ou organes. Des « anticorps » normalement produits par certaines cellules immunitaires pour neutraliser l’ « ennemi » en se fixant à certaines de ses molécules (antigènes) peuvent aussi apparaître et viser des éléments de notre organisme.
Ainsi, dans le diabète de type 1 (encadré), des auto-anticorps ciblent les cellules du pancréas sécrétrices d’insuline. Dans la polyarthrite rhumatoïde, c’est la membrane qui entoure les articulations qui est visée, l’inflammation s’étendant ensuite aux cartilages, aux os, voire aux tendons et ligaments. Dans le lupus érythémateux disséminé, les auto-anticorps sont dirigés contre des molécules présentes sur de nombreuses cellules du corps, conduisant à léser plusieurs organes (peau, articulations, reins, cœur…).

Diabète de type 1 : un gène clé à l’étude
Responsable de 10% des cas de diabète dans le monde, le diabète de type 1 ou diabète juvénile frappe dès l’enfance. Cette maladie auto-immune due à la destruction des cellules du pancréas sécrétrices d’insuline implique des injections quotidiennes de l’hormone vitale. Dans l’équipe Immunologie des diabètes de l’Institut Cochin, Ute Rogner étudie l’action d’un gène impliqué dans cette maladie qu’elle a identifié en 2006 à l’Institut Pasteur. Ce gène semble être à la source de la maladie. Il sert à fabriquer une protéine (Arntl2) qui régule une molécule immunitaire responsable de la prolifération des cellules diabétogènes (l’interleukine 21). “Nos études visent à comprendre très précisément toute la chaîne des événements moléculaires et cellulaires déclenchés par Arntl2 ”, précise Ute Rogner. “Ces recherches devraient révéler de nouvelles cibles thérapeutiques. De plus, il serait souhaitable de trouver des marqueurs pour dépister plus tôt les malades atteints du diabète de type 1 dans les familles à risque, et Arntl2 pourrait être l’un d’entre eux.” Un gène d’autant plus intéressant qu’il semble aussi lié au diabète de type 2.

Des maladies inflammatoires chroniques
Dans certains cas, on ne trouve pas d’auto-anticorps, et on parle alors plutôt de maladies « auto-inflammatoires ». Des cellules immunitaires de la première ligne de défense de l’organisme (neutrophiles, macrophages, monocytes, cellules tueuses naturelles…) déclenchent à elles seules une inflammation chronique conduisant à la destruction de certains tissus : la peau dans le psoriasis (qui touche 3 à 5 % de la population européenne), certaines articulations dans la spondylarthrite rhumatoïde (voir plus loin), le tube digestif dans la maladie de Crohn, le système nerveux central -cerveau, moelle épinière, nerf optique - dans la sclérose en plaques (voir plus loin). Qu’elles soient auto-immunes au sens strict ou auto-inflammatoires, toutes ces pathologies résultent d’un dysfonctionnement du système immunitaire et évoluent en maladies inflammatoires chroniques.
Neutrophiles © Institut Pasteur
La spondylarthrite ankylosante
Aussi fréquente que la polyarthrite rhumatoïde, la spondylarthrite ankylosante est une maladie très handicapante et douloureuse qui concerne 300 000 personnes en France et près d’un million et demi d’Européens. Survenant le plus souvent chez des hommes jeunes (entre 20 et 40 ans), cette maladie auto-inflammatoire chronique touche l’articulation sacro-iliaque de la colonne vertébrale et parfois aussi les articulations des membres. L’inflammation s’accompagne d’une formation anormale d’os nouveau qui « soude » les vertèbres entre elles. La colonne vertébrale n’est plus flexible, et la personne se courbe de plus en plus. Cette maladie à forte composante génétique est à l’étude à l’Institut Pasteur dans l’unité d'Immunorégulation dirigée par Lars Rogge, qui a créé en 2016 une unité mixte de recherche sur la spondylarthrite ankylosante avec le service de rhumatologie de l’hôpital Cochin.
« Nous nous intéressons en particulier à des molécules utilisées dans le traitement de cette maladie, qui bloquent une cytokine inflammatoire, le TNF, et nous venons d’élucider leur mécanisme d’action », explique le chercheur. « Ceci pourrait permettre d’agir sur de nouvelles voies de la maladie et aussi d’identifier chez les patients des « signatures » prédisant l’efficacité de la réponse aux anti-TNF, sans effet chez un tiers d’entre eux. Des analyses chez 70 patients nous ont permis d’identifier des molécules candidates en vue de définir des biomarqueurs de la réponse thérapeutique. Nous démarrons une étude sur 200 patients pour explorer ces pistes, et aussi comprendre le mode d’action d’une autre molécule dont l’intérêt pour le traitement la spondylarthrite ankylosante a été montré récemment : l’anti-IL17. Grâce à la cohorte de volontaires sains de Milieu Intérieur , nous allons aussi comparer les réponses immunitaires de personnes en bonne santé et malades. »
A la clé ? Des outils qui permettront aux médecins de savoir quel type de traitement administrer à leurs patients.

Lars Rogge, responsable de l'unité d' Immunorégulation à l’Institut Pasteur.
Grâce à la cohorte de volontaires sains de Milieu Intérieur, nous allons aussi comparer les réponses immunitaires de personnes en bonne santé et malades.
De multiples facteurs de risque
D’où vient ce dérèglement ? Cela reste très mal connu (voir entretien ci-dessous), mais de nombreux facteurs sont liés à la survenue des maladies auto-immunes, comme les hormones sexuelles, les femmes étant plus souvent touchées que les hommes : la thyroïdite auto-immune par exemple survient dans 80% des cas chez des femmes (et touche 3 à 5 % d’entre elles).

Le terrain génétique est important, d’où le caractère souvent familial de ces maladies. La fréquence du diabète de type 1 passe par exemple de 0,4 % dans la population générale à 5 % chez les apparentés d’un diabétique. Des dizaines voire des centaines de gènes, souvent impliqués dans l’immunité, ont été associés à chaque maladie auto-immune. Certains interviennent dans l’identité biologique de l’individu, codant des protéines de reconnaissance du soi situées à la surface de nos cellules, comme le gène HLA-B27, un gène présent chez plus de 80 % des malades atteints de spondylarthrite ankylosante mais chez seulement 7 % des sujets sains.
L’environnement - exposition aux microbes, à certaines substances chimiques, aux U.V., tabagisme… - joue également un rôle majeur. Pour certains, l’augmentation de la prévalence des maladies auto-immunes dans les pays industrialisés serait une conséquence de l’hygiène et de l’utilisation des antibiotiques. Etre moins soumis à l'épreuve des infections pourrait être un facteur de risque...

En général, un seul facteur n’est pas suffisant pour déclencher une maladie auto-immune. Chaque facteur a néanmoins un petit effet, et les effets de tous les facteurs additionnés font la maladie.
D’où vient le dérèglement immunitaire à l’origine des maladies auto-immunes?
Il y a plusieurs théories. L’une, assez ancienne, stipule qu’on s’attaque à soi-même parce que certains éléments du soi ressembleraient à un microbe : on est infecté par un virus, et les anticorps produits contre un antigène de ce virus « voient » un constituant de notre organisme très similaire et le prennent pour cible. C’est le « mimétisme antigénique ». Des exemples bien précis ont été documentés, mais cela reste à être démontré dans les maladies comme la sclérose en plaques ou l’arthrite rhumatoïde. Une théorie plus moderne est que les personnes touchées ont simplement une propension plus forte à réagir, leurs réponses immunitaires démarrant au quart de tour. Notre système immunitaire peut naturellement réagir contre le soi, mais ceci est régulé, freiné. Chez certains, soit des freins lâchent, soit le moteur est trop puissant. Le mode d’action de certains gènes associés aux maladies auto-immunes vient à l’appui de cette théorie. La troisième hypothèse est que la suractivation serait provoquée par une infection. Après un contact avec un microbe, le système immunitaire serait tellement activé qu’il réagirait plus facilement contre le soi.
Pourquoi cette difficulté à trouver les mécanismes en jeu ?
Si l’on cherche les causes de la mucoviscidose, c’est relativement facile : un seul gène est muté qui explique la maladie. Pour ce qui est des maladies inflammatoires chroniques, elles se développent sur des dizaines d’années et de très nombreux facteurs de risque interviennent. Des études sur le génome de milliers de personnes ont montré l’implication d’une quantité considérable de gènes, des centaines pour la seule maladie de Crohn. A cela s’ajoutent les facteurs de l’environnement, le vécu, le comportement alimentaire… En général, un seul facteur n’est pas suffisant pour déclencher la maladie. Chaque facteur a néanmoins un petit effet, et les effets de tous les facteurs additionnés font la maladie. C’est pourquoi l’étude de ces maladies est si compliquée.
Vous êtes immunologiste et travaillez sur le microbiote intestinal. De quoi s’agit-il ?
Nous cherchons à comprendre comment le microbiote intestinal intervient dans la régulation du système immunitaire. Nous savons qu’il y a des échanges, un dialogue en quelque sorte, entre les bactéries intestinales et les cellules immunitaires. Nous voulons comprendre les lois qui régissent cette interface, et comment elle peut être dérégulée, en travaillant sur des systèmes sains, ainsi que sur des modèles de colite et d’arthrite. Il a été montré que les maladies auto-immunes mènent à une baisse de la diversité du microbiote. Il pourrait donc y avoir une perte de certaines souches bactériennes qui nous protègent de ces maladies. Par exemple, la bactérie Faecalibacterium prausnitzii est présente chez les personnes saines mais manque chez certains patients développant des maladies inflammatoires chroniques de l’intestin. On pourrait imaginer la ré-implanter chez les malades.
Les recherches sur le microbiote pourraient donc déboucher sur de nouveaux traitements ?
C’est l’idée. Mais si on sait aujourd’hui étudier les bactéries du microbiote une à une, dans la réalité, elles communiquent avec leurs milliards de voisines dans l’intestin. La bactérie A a besoin de la bactérie B qui a besoin de la bactérie C… Il s’agit donc d’un écosystème extrêmement complexe que nous devons déchiffrer. Un autre problème est de pouvoir cultiver les bactéries bénéfiques, et les conditions ne sont pas forcément encore réunies pour les manipuler. Mais en cherchant pourquoi et comment une bactérie nous protège, nous allons sans doute trouver les substances qu’elle produit et qui régulent le système immunitaire. On pourra alors synthétiser ces produits …
« Nous savons qu’il y a des échanges, un dialogue en quelque sorte, entre les bactéries intestinales et les cellules immunitaires. Nous voulons comprendre les lois qui régissent cette interface. »
Dompter le système immunitaire
Hormis dans le diabète de type 1 où il s’agit de remplacer l’insuline manquante, le traitement des maladies auto-immunes visent globalement à contrôler et réduire la réponse immunitaire et l’inflammation.
Les corticoïdes, de par leur effet anti-inflammatoire, constituent la thérapie de base mais peuvent avoir des effets nocifs à long terme. Des immunosuppresseurs comme la cyclosporine, aussi utilisée comme médicament anti-rejet dans les greffes d’organe, sont également administrés. Mais en supprimant la réaction auto-immune, ils diminuent aussi la capacité de l’organisme à se défendre contre les micro-organismes (bactéries, virus…) ou à se débarrasser de cellules cancéreuses. Le risque de développer certaines infections ou cancers implique un suivi particulier des patients.

Reportage LabEx Milieu Intérieur. Crédit : Institut Pasteur
Qu’est-ce qu’un système immunitaire « sain » ? Le projet « Milieu Intérieur ».
En raison de la complexité des réponses immunitaires dans l’individu et dans la population, il n’a pas été possible jusqu’à présent de définir les paramètres – génétiques ou environnementaux – qui définissent un système immunitaire sain et sa variabilité naturelle. Le Consortium Milieu Intérieur, coordonné à l’Institut Pasteur*, réunit 30 équipes dans diverses institutions de recherche et hôpitaux dans l’objectif de caractériser le système immunitaire des individus en bonne santé. Depuis 2012, ces chercheurs de plusieurs disciplines scientifiques (immunologie, génomique, biologie moléculaire, bioinformatique) participent à une vaste étude portant sur 1000 volontaires sains. « Cette recherche ouvrira la voie à la médecine personnalisée: l’adaptation de la bonne stratégie thérapeutique pour la bonne personne au bon moment. » La cohorte Milieu Intérieur est également utile à plusieurs équipes de recherche travaillant sur les maladies autoimmunes et autoinflammatoires pour comparer des caractéristiques immunitaires des malades à ceux de personnes en bonne santé.
Le Consortium Milieu Intérieur a été labellisé « Laboratoire d’excellence » dans le cadre du programme gouvernemental des Investissements d’Avenir.
* par Lluis Quintana-Murci, directeur, et Darragh Duffy, coordinateur.

L’essor des biomédicaments
Troisième catégorie de traitements : les biomédicaments. Il s’agit d’administrer des « cytokines », ces molécules messagères produites par les cellules immunitaires, ou au contraire de les inhiber. Les chefs de file de ces biomédicaments sont les « anti-TNF-alpha », qui ont provoqué dès 1997 une petite révolution en rhumatologie avec des résultats spectaculaires contre la polyarthrite rhumatoïde : comme leur nom l’indique, ils bloquent le TNF-alpha, une cytokine qui active l’inflammation, et sont aujourd’hui également prescrits contre la maladie de Crohn ou le psoriasis. Des cytokines intervenant dans la régulation du système immunitaire sont également utilisées comme l’interféron bêta dans la sclérose en plaques. Contrairement aux immunosuppresseurs classiques qui agissent de manière globale sur le système immunitaire, ces biomédicaments interviennent sur des voies particulières, réduisant une population donnée de cellules immunitaires ou bloquant leur migration vers les organes touchés par la maladie. Ils font l’objet de nombreux essais dans le monde et leur essor est lié à la compréhension de plus en plus fine des événements en jeu dans chaque maladie auto-immune, et du scénario précis de l’implication de chaque cytokine.
Sclérose en plaques : l’espoir des biomarqueurs et de traitements radicalement nouveaux
Maladie auto-immune et neurodégénérative, la sclérose en plaques touche 2,5 millions de personnes dans le monde, dont 80 000 en France, et trois fois plus de femmes que d’hommes. Due à la destruction progressive de la « gaine d’isolation » des fibres nerveuses dans le cerveau, elle se manifeste dès l’âge de 30 ans par des poussées inflammatoires, parfois espacées de plusieurs mois, après lesquelles le malade récupère… mais de moins en moins avec le temps. Après cette première phase qui dure de 5 à 20 ans, une deuxième phase « progressive » s’installe, conduisant à une aggravation des troubles sensoriels et musculaires, souvent à une difficulté majeure pour la marche. Une prédisposition génétique, des facteurs environnementaux comme le manque d’ensoleillement ou la latitude (la maladie est beaucoup plus fréquente aux deux pôles terrestres), le fait d’avoir eu une mononucléose infectieuse ou l’obésité à l’adolescence, ou encore le tabagisme sont des facteurs de risque.
Prédire la réponse au traitement par l’interféron
Le traitement consiste en l’administration de cortisone et d’immunomodulateurs, notamment l’interféron béta, qui réduit d’environ 30% la fréquence des poussées et de 60% celle de nouvelles lésions. « Cet interféron est utilisé depuis 1993 contre la sclérose en plaques mais son mode d’action reste mal connu », souligne Frédérique Michel dans l’unité de Signalisation des cytokines de l’Institut Pasteur, dirigée par Sandra Pellegrini. « C’est une molécule fascinante car dotée de trois propriétés très différentes : elle a un effet antiviral – c’est une des premières molécules de l’immunité secrétée quand un virus attaque l’organisme - ; elle est utilisée dans le traitement de certains cancers par son action inhibitrice sur la multiplication des cellules ; et enfin elle intervient dans la régulation du système immunitaire, et c’est ce qui nous intéresse ici. Nous menons actuellement une étude de la réponse immunitaire de patients traités par l’interféron bêta, en collaboration avec des neurologues de l’hôpital Pitié-Salpêtrière à Paris. Grâce à des approches technologiques nouvelles et performantes nous analysons plusieurs centaines de gènes et de protéines ainsi que des populations cellulaires impliquées dans le contrôle de la réponse immunitaire. Nous espérons ainsi découvrir des biomarqueurs de la réponse thérapeutique car aujourd’hui, environ 30 % des patients ne répondent pas à ce traitement. » Des pistes sont en cours d’investigation chez une cinquantaine de malades, offrant l’espoir d’une meilleure prise en charge de la sclérose en plaques.

Frédérique Michel, unité de Signalisation des cytokines à l’Institut Pasteur.
C’est une molécule fascinante car dotée de trois propriétés très différentes
Reprendre le contrôle des gènes de l’immunité
Dans un autre laboratoire, Christian Muchardt, responsable de l’unité de Régulation épigénétique, suit une toute autre piste. « Des protéines de virus ont été trouvées dans des globules blancs de patients atteints de sclérose en plaques », explique-t-il. « Leur présence n’est pas la conséquence d’une attaque virale, mais provient de l’activation de séquences génétiques de virus qui se sont insérées au cours de l’évolution dans notre ADN, des vestiges en quelque sorte. Chez les personnes saines, elles sont gardées sous contrôle. » En cherchant à comprendre pourquoi ce contrôle est perturbé chez des patients, l’équipe de Christian Muchardt a identifié un mécanisme épigénétique* responsable de cette dérégulation, et a surtout montré qu’il conduit aussi à déréguler des gènes de l’immunité. « Nous cherchons maintenant à corriger le mécanisme défectueux avec des molécules qui seront de bonnes candidates pour de futurs médicaments contre la sclérose en plaques ».
*Qui implique des protéines s’associant à l’ADN pour réduire ou augmenter l’expression des gènes.

Christian Muchardt, responsable de l’unité de Régulation épigénétique à l’Institut Pasteur.
Nous cherchons maintenant à corriger le mécanisme défectueux avec des molécules qui seront de bonnes candidates pour de futurs médicaments contre la sclérose en plaques .
Microbiote et thérapie cellulaire
Enfin, les maladies auto-immunes devraient bénéficier de l’étude du microbiote - nos bactéries intestinales semblant intervenir dans la régulation du système immunitaire - ou de la recherche sur les cellules souches, pour restaurer les organes lésés en y injectant ces cellules capables de se différencier et de fonctionner localement, pour reconstituer par exemple le cartilage afin de « réparer » les articulations dans les maladies arthritiques.
Différents champs de recherche laissent donc espérer des traitements plus puissants et plus ciblés contre ces maladies complexes. Il s’agit de parvenir à réparer les erreurs d’aiguillage de défenses immunitaires qui se sont dramatiquement trompées de cible…
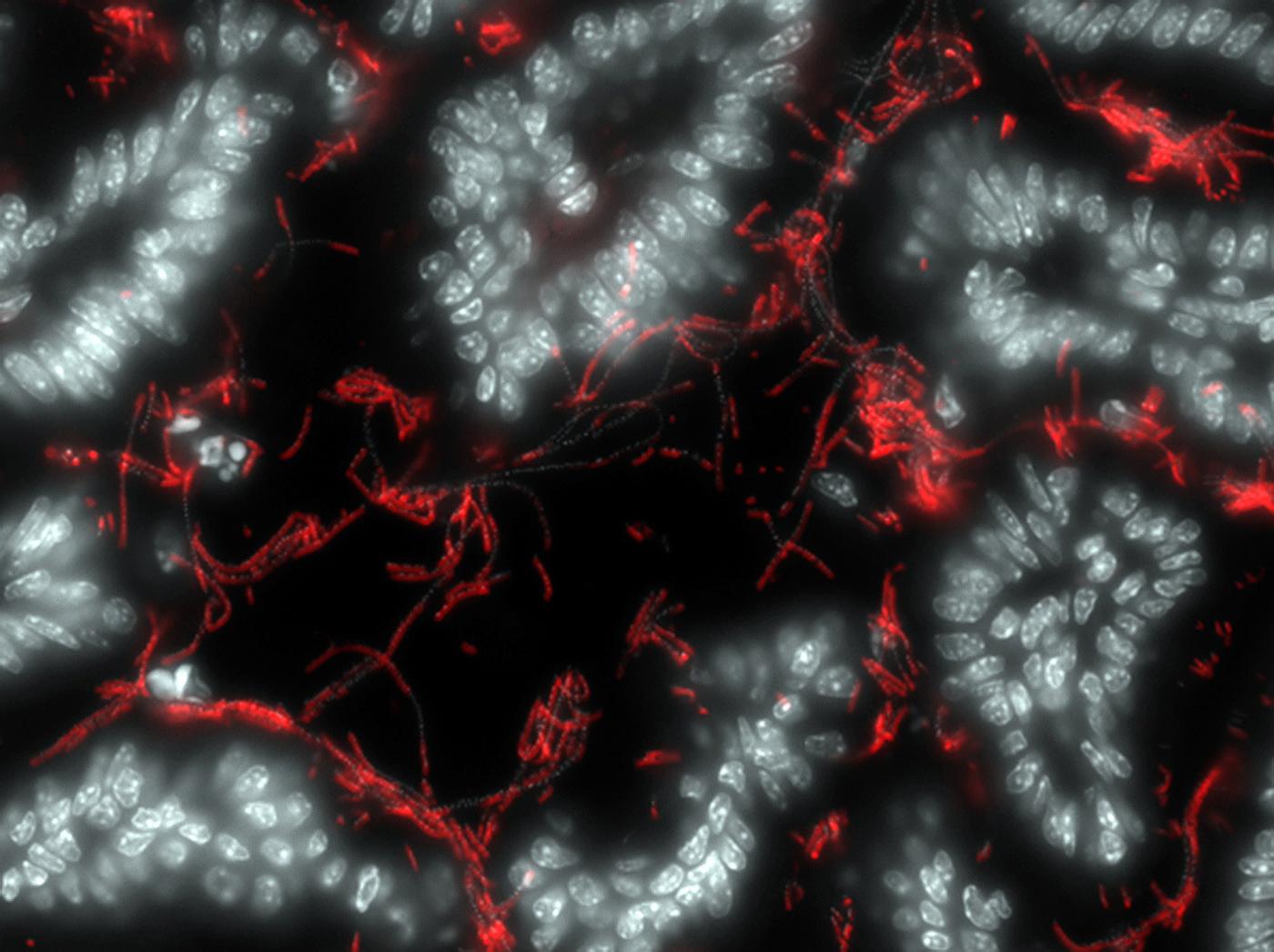
Bactérie symbiotique (rouge) attachée à l'intestin (en blanc). © Institut Pasteur