L’immunité innée est le composant le plus rapide du système immunitaire, et son rôle reste encore peu caractérisé lors des infections par le SARS-CoV-2. Quelques heures après une infection, l’organisme émet un signal d’alarme (l’interféron) permettant aux cellules non encore infectées de fabriquer des protéines antivirales. Ce phénomène a lieu bien avant la production d’anticorps neutralisants. Des chercheurs de l’Institut Pasteur et du CNRS ont étudié les conséquences de l’infection par SARS-CoV-2 sur le fonctionnement de la cellule, et le rôle antiviral de l’immunité innée. Ils montrent, en utilisant notamment la vidéo-microscopie en temps réel, que les cellules infectées en culture peuvent fusionner avec les cellules avoisinantes, et meurent après avoir formé des cellules géantes composées de dizaines de cellules, appelées « syncytia ». Cependant, l’interféron contrecarre ce phénomène, en induisant des protéines cellulaires empêchant la fusion des cellules infectées. Ces résultats montrant l’effet antiviral de l’immunité innée ont été publiés dans The EMBO Journal, le 13 octobre 2020.
Le rôle de l’immunité innée lors de la COVID-19 reste encore peu connu. Différentes équipes dans le monde, dont une équipe française, ont récemment montré que les formes sévères sont associées à un déficit de production d’interféron par l’organisme1. Le traitement par l’interféron montre aussi des effets bénéfiques chez certains patients. L’interféron est une substance à activité antivirale, qui va stimuler les défenses naturelles de chaque cellule, en induisant la synthèse de protéines qui vont les protéger de l’infection. L’immunité innée est très rapide, et peut agir en quelques heures, bien avant l’apparition des deux autres formes d’immunité : l’immunité humorale (correspondant à la production d’anticorps neutralisant l’entrée du virus dans les cellules) et l’immunité cellulaire (qui comprend des globules blancs, tels que les lymphocytes cytotoxiques, capables de détruire les cellules infectées).
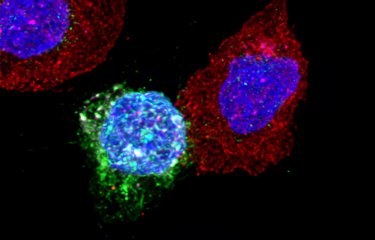
Les chercheurs de l’unité Virus et immunité (Institut Pasteur / CNRS) se sont intéressés à la « fusion virale », le mécanisme de mélange des membranes du virus et de la cellule qui permet l’entrée du matériel génétique viral dans la cellule cible. La fusion virale peut aussi avoir lieu lorsque la cellule est infectée et produit de nouveaux virus. Grâce à des approches de vidéo-microscopie en temps réel, les scientifiques ont montré que les cellules infectées fusionnent avec les cellules avoisinantes, formant des « syncytia », c’est à dire des cellules géantes englobant des dizaines de cellules productrices de virus, et qui finissent par mourir. Le rôle de ces syncytia dans la maladie COVID-19 n’est pas encore bien caractérisé, mais une équipe de médecins italiens et anglais a montré, en réalisant des autopsies pulmonaires de patients décédés, que ces syncytia étaient présents chez une grande partie des patients atteints de formes graves2.
Les auteurs de l’étude ont également étudié le rôle de l’interféron sur la formation des syncytia. Des protéines induites par l’interféron, appelées IFITM (pour interferon-induced-transmembrane proteins) peuvent avoir des rôles contradictoires sur les différents coronavirus. Les scientifiques ont montré que dans le cas de cellules infectées par SARS-CoV-2, les protéines IFITM inhibent la formation de syncytia, apportant un éclairage sur la manière dont l’interféron pourrait contrôler l’évolution de la COVID-19. Ces observations originales, obtenues dans des modèles in vitro de sur-expression de IFTIM doivent être reproduites dans des modèles physiologiques de cellules bronchiques humaines.
« Nos résultats permettent de mieux comprendre les effets délétères du SARS-CoV-2 sur les cellules, ainsi que le rôle de l’immunité innée et de l’interféron dans le contrôle de l’infection » commente Olivier Schwartz, principal auteur de l’étude et responsable de l’unité Virus et Immunité à l’Institut Pasteur.
2 https://www.medrxiv.org/content/10.1101/2020.06.22.20136358v1
Source
Syncytia formation by SARS-CoV-2 infected cell, The EMBO Journal, 13 octobre 2020
Julian Buchrieser1,2†, Jeremy Dufloo1,2†, Mathieu Hubert1,2†, Blandine Monel1,2†, Delphine Planas1,2,6†, Maaran Michael Rajah1,2, Cyril Planchais3, Françoise Porrot1,2, Florence Guivel-Benhassine1,2, Sylvie Van der Werf4,5, Nicoletta Casartelli1,2, Hugo Mouquet3, Timothée Bruel1,2, Olivier Schwartz1,2,6
1 Virus and Immunity Unit, Department of Virology, Institut Pasteur, Paris, France
2 CNRS-UMR3569, Paris, France.
3 Laboratory of Humoral Immunology, Department of Immunology, Institut Pasteur, INSERM U1222, Paris, France
4 Molecular Genetics of RNA Viruses, Department of Virology, Institut Pasteur CNRS UMR 3569; Université de Paris, Paris, France
5 National Reference Center for Respiratory Viruses, Institut Pasteur, Paris, France 6 Vaccine Research Institute, Créteil, France.
† first co-authors, (alphabetical order)