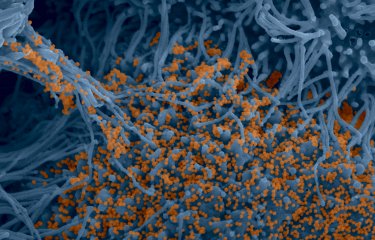
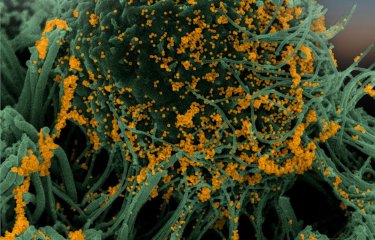
Les chauves-souris sont des espèces réservoirs de nombreux virus dont les coronavirus. Étant donné qu’elles ne semblent pas affectées par les maladies transmises par ces virus, il apparait intéressant de comprendre comment leur système immunitaire parvient à en réguler l’infection. Des scientifiques de l’Institut Pasteur et du CNRS ont étudié la réplication du SARS-CoV-2 dans des cellules de chauve-souris, en utilisant notamment, pour la première fois, des techniques d’imagerie en temps réel. Ils montrent qu’il existe une spécificité de la réponse immunitaire selon les espèces de chauve-souris et selon les types de cellules. Ces résultats ont été publiés dans The Journal of Virology, le 05 juillet 2022.
Les chauves-souris sont les espèces réservoirs de nombreux virus. Elles sont porteuses de certains virus qui ne les rendent pas malades à la suite de l’infection contrairement à l’humain ou à d’autres mammifères. Les chauve-souris auraient donc un système immunitaire qui pourrait contrôler certaines infections virales de manière efficace. Des scientifiques de l’Institut Pasteur et du CNRS ont étudié la réplication du SARS-CoV-2 dans des cellules de chauve-souris dans le but de comprendre comment les cellules de ces animaux répondent à l’infection virale.
Les scientifiques ont tout d’abord établi des modèles cellulaires. Ils ont rassemblé des lignées cellulaires préalablement générées par d’autres laboratoires, notamment ceux du réseau de collaborateurs du Centre national de référence de la rage à l’Institut Pasteur, et en ont développées de nouvelles. Les cultures de cellules de chauve-souris sont réalisées à partir de différentes espèces de chauve-souris et à partir de différents organes (cerveau, peau, voies digestives). « Ces animaux représentent le deuxième plus grand groupe de mammifères au monde avec près de 1 400 espèces différentes, il est important de disposer d’un panel de modèles cellulaires de chauve-souris le plus large possible afin de comparer, voire de généraliser nos résultats. De plus, ces modèles cellulaires restent essentiels pour toute étude portant sur les chauves-souris. » explique Laurent Dacheux, chercheur dans l’unité Lyssavirus, épidémiologie et neuropathologie, responsable adjoint du Centre national de référence de la rage à l’Institut Pasteur et co-principal auteur de l’étude.
Les équipes scientifiques ont adapté ces cultures cellulaires en les modifiant pour qu’elles expriment le récepteur d’entrée du virus, la protéine humaine ACE2. Ils constituent ainsi une collection de lignées cellulaires pertinentes pour la recherche sur le SARS-COV2 et d’autres virus apparentés.
Les lignées cellulaires sont ensuite infectées par le SARS-CoV-2 et observées par différentes techniques de microscopie, dont de la microscopie optique en temps réel. « C‘est la première fois qu’il est possible de visualiser la réplication du SARS-CoV-2 dans des cellules vivantes de chauve-souris » indique Nolwenn Jouvenet, directrice de recherche au CNRS, responsable de l’unité Signalisation antivirale à l’Institut Pasteur et co-principale auteure de l’étude. La prise d’image à intervalle de temps régulier indique aux scientifiques la vitesse à laquelle les cellules sont infectées. Pour certaines lignées cellulaires, les cellules meurent rapidement et les syncytia[1] sont rapidement formés.
Vidéo de cellules dérivées d’un cerveau de grand murin (Myotis myotis) infectées par le SARS-CoV-2 (à droite) ou non-infectées (à gauche). Les cellules sont cultivées dans un milieu contenant de l'iodure de propidium comme marqueur de mort cellulaire. Les cellules ont été photographiées toutes les 15 minutes pendant 48 heures. © Delphine Planas, Sophie Aicher, Nolwenn Jouvenet (Institut Pasteur)
« L’installation d’un microscope dans un laboratoire de type P3 en pleine pandémie de Covid-19 nous a permis de visualiser en temps réel les conséquences de l’infection par SARS-CoV-2 sur le fonctionnement de la cellule. » ajoute Olivier Schwartz responsable de l’unité Virus et immunité à l’Institut Pasteur[2] et co-auteur de l'étude.
Grâce à ces cellules de chauve-souris exprimant ACE2 et à des techniques variées de virologie, de biochimie et d’imagerie optique et électronique, les chercheurs montrent que la réplication du virus est contrôlée au cours du temps dans certaines lignées de cellules de chauves-souris, et que ce contrôle est en lien avec la mise en place d’une réponse immunitaire immédiate de forte amplitude à laquelle le virus ne peut échapper.
Selon les lignées cellulaires, le virus est bloqué à différents stades de sa réplication. Dans certaines lignées cellulaires, le virus, bien qu’il pénètre dans la cellule, ne parvient pas à se répliquer. Dans d’autres lignées, le virus parvient à se multiplier mais les particules virales ne sont pas libérées dans le milieu extracellulaire. L’ensemble de ces résultats suggère l’existence de barrières moléculaires spécifiques à chaque espèce, qui agissent sur la réplication des coronavirus dans les cellules des chauve-souris.
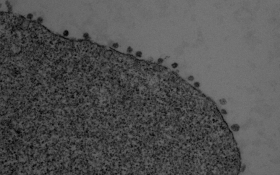 |
Image de microscopie électronique montrant l’accumulation de particules virales à la surface de cellules dérivées d’un cerveau de chauve-souris (espèce Myotis myotis). © Philippe Roingeard (Université de Tours), Sophie-Marie Aicher, Nolwenn Jouvenet (Institut Pasteur/CNRS) |
« Notre travail consiste désormais à identifier et à caractériser les protéines induites par la réponse immunitaire chez la chauve-souris et que le SARS-CoV-2 n’arrive pas à contrer. » ajoute Nolwenn Jouvenet. Pour cela, les scientifiques vont utiliser la large collection de lignées cellulaires constituée ainsi que des techniques à haut débit de type transcriptomique en vue d’identifier les gènes de l’immunité qui possèdent des propriétés antivirales. « Aujourd’hui encore nous ne savons pas pourquoi le système immunitaire des chauve-souris est si efficace vis-à-vis des coronavirus. L’enjeu reste de mieux comprendre comment cet animal réservoir peut être porteur de virus qui ont un effet sur la santé globale. » conclue-t-elle.
|
Une vidéo primée par Nikon en 2021 au concours « Small World in Motion ». Le 16 août 2021, des chercheuses de l’unité Signalisation antivirale et de l’unité Virus et immunité à l’Institut Pasteur obtiennent la mention honorable au concours vidéo Small World in Motion organisé par Nikon. La vidéo prise en microscopie met pour la première fois en évidence l’infection de cellules de chauve-souris par le SARS-CoV-2. Une image est prise toutes les 15 minutes pendant 48 heures. Une molécule fluorescente rouge est utilisée pour visualiser la mort cellulaire. Ce marqueur rouge rentre dans la cellule quand elle est en train de mourir et permet de quantifier la mort cellulaire. |
[1] Les syncytia sont des cellules géantes composées de dizaines de cellules.
[2] Au CNRS, cette unité a pour dénomination « Virologie » (CNRS/Institut Pasteur).
Source
Species-specific molecular barriers to SARS-CoV-2 replication in bat cells, Journal of Virology, 5 juillet 2022
Sophie-Marie Aicher1, Felix Streicher1, Maxime Chazal1, Delphine Planas2,3, Dongsheng Luo4, Julian Buchrieser2, Monika Nemcova5, Veronika Seidlova5, Jan Zukal6, Jordi Serra-Cobo7,8, Dominique Pontier9,10, Bertrand Pain11, Gert Zimmer12, Olivier Schwartz2,3, Philippe Roingeard13, Jiri Pikula5, Laurent Dacheux4*, Nolwenn Jouvenet1*
1 Institut Pasteur, Université de Paris Cité, CNRS UMR 3569, Virus sensing and signaling Unit, Paris, France
2 Institut Pasteur, Université de Paris Cité, CNRS UMR 3569, Virus and Immunity Unit, Paris, France
3 Vaccine Research Institute, Créteil, France
4 Institut Pasteur, Université de Paris Cité, Lyssavirus Epidemiology and Neuropathology Unit, Paris, France
5 Department of Ecology and Diseases of Zoo Animals, Game, Fish and Bees, University of Veterinary Sciences Brno, Brno, Czech Republic
6 Institute of Vertebrate Biology of the Czech Academy of Sciences Brno, Czech Republic
7 Institut de Recerca de la Biodiversitat (IRBio), Faculty of Biology, Universitat de Barcelona, Barcelona, Spain
8 Departament de Biologia Evolutiva, Ecologia i Ciències Ambientals, Facultat de Biologia, Universitat de Barcelona
9 Université de Lyon, LabEx Ecofect, Lyon, France
10 Université Lyon 1, CNRS, Laboratoire de Biométrie et Biologie Evolutive UMR5558, Villeurbanne, France
11 University of Lyon, Université Lyon 1, INSERM, INRAE, Stem Cell and Brain Research Institute, U1208, USC1361, Bron, France.
12 Institute of Virology and Immunology, Bern & Mittelhäusern, Switzerland, and Department of Infectious Diseases and Pathobiology, Vetsuisse Faculty, University of Bern, Bern, Switzerland
13 INSERM U1259 MAVIVH and Plateforme IBiSA de Microscopie Electronique, Faculté de Médecine, Université de Tours, Tours, France
*co-corresponding/co-senior authors