Des chercheurs de l’Institut Pasteur de Dakar et de l’Institut Pasteur à Paris sont parvenus à reconstruire les chaînes de transmission du virus Ebola et leur contexte, au sein de la capitale guinéenne, de février à août 2014. Ces données mettent en évidence l’impact positif des mesures de contrôle sur l’évolution de l’épidémie mais soulignent les défis à surmonter pour contenir cette épidémie dans les grands centres urbains. Elles sont publiées dans la revue The Lancet Infectious Diseases.
Communiqué de pesse
Paris, le 23 janvier 2015
Une épidémie d’Ebola d'ampleur sans précédent sévit en Afrique de l'Ouest depuis décembre 2013, touchant pour la première fois les grands centres urbains comme Conakry, capitale de la Guinée. Afin de mieux comprendre et de caractériser la transmission d’Ebola pour pouvoir améliorer les stratégies de contrôle, des chercheurs de l’Institut Pasteur de Dakar, menés par Amadou Sall, et de l’Institut Pasteur à Paris, de l’équipe de Simon Cauchemez (unité Modélisation mathématique des maladies infectieuses), ont reconstruit les chaînes de transmission du virus ainsi que leur contexte dans la capitale guinéenne, de février à août 2014.
Ce travail d’enquête, menée par des équipes de l’Institut de Dakar et de partenaires locaux auprès des patients, de leurs familles et de leurs voisins, a permis de mesurer la transmission d’Ebola entre individus dans différents contextes et à différents moments de l’épidémie. En mars, les transmissions lors de funérailles représentaient 15%, et celles à l’hôpital 35% de toutes les transmissions. Ces proportions ont ensuite respectivement chuté à 4% et 9% à partir d'avril, quand des funérailles sécurisées ont été mises en place et qu’un centre de traitement a été ouvert. Les chercheurs ont également établi que les malades hospitalisés infectaient en moyenne deux fois moins de personnes dans la communauté que les autres. Ces données montrent que la majorité des transmissions se sont faites dans la famille ou la communauté et que le renforcement des mesures de contrôle et d’isolement des malades a permis de ralentir substantiellement la progression de l’épidémie de Conakry.
Néanmoins ces mesures ont été insuffisantes pour stopper complètement l’épidémie puisqu’on a pu constater trois pics épidémiques de février à août : le premier (le 24 février) est dû à l’introduction à Conakry d’un cas provenant d’une autre ville du centre de la Guinée (Dabola), le deuxième (le 24 mars) à des cas non déclarés par leur famille, et le troisième (le 30 juin) à une introduction d’un cas provenant de la Sierra Leone. Les chaînes de transmission initiées à Conakry ont également été exportées vers d’autres territoires en Guinée.
Enfin, les enquêtes couplées à l’analyse des échantillons biologiques révèlent que plus la virémie (taux de particules virales présentes dans le sang) est élevée chez un malade, plus le nombre de personnes qu’il risque de contaminer est important.
En révélant les conditions de transmission, ces analyses soulignent les défis à surmonter pour contrôler cette épidémie dans les grands centres urbains et devraient permettre d’adapter les réponses sur le terrain. Les données épidémiologiques qu’elles apportent pourront être corrélées prochainement avec le séquençage des souches prélevées sur place depuis le début de l’épidémie, en cours d’analyse par les chercheurs de l’Institut Pasteur et du Réseau International des Instituts Pasteur.
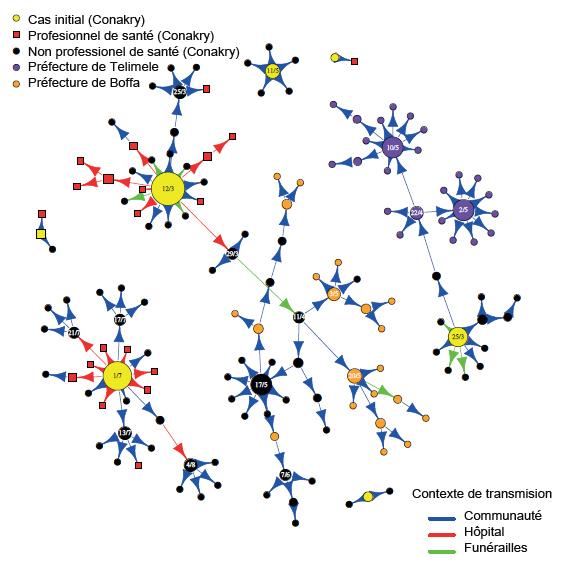
Illustration : Arbres de transmission du virus Ebola. Dans les cercles sont inscrites les dates de début de symptômes pour les cas ayant infectés plus de 3 personnes. La taille des cercles est proportionnelle au nombre de personnes que le cas a infecté. © Institut Pasteur
Source
Chains of transmission and control of Ebola Virus Disease in Conakry, Guinea in 2014, The Lancet Infectious Diseases, 23 janvier 2015
Ousmane Faye (1,†), Pierre-Yves Boëlle (2,3,†), Emmanuel Heleze (4), Oumar Faye (1), Cheikh Loucoubar (1), N’Faly Magassouba (5), Barré Soropogui (5), Sakoba Keita (6), Tata Gakou (6), El Hadji Ibrahima Bah (7), Lamine Koivogui (8), Amadou Alpha Sall (1,‡), Simon Cauchemez (9,‡)
(1) Arbovirus and viral hemorrhagic fever Unit, Institut Pasteur de Dakar, Dakar, Senegal
(2) INSERM, UMR-S 1136, Institut Pierre Louis d’Epidemiologie et de Sante Publique, Paris, France
(3) Sorbonne Universités, UPMC Univ Paris 06, UMR-S 1136, Institut Pierre Louis d’Epidemiologie et de Santé Publique, Paris, France
(4) World Health Organization
(5) Projet de fièvres hémorragiques de Guinée, Université Gamal Abdel Nasser, Conakry, Guinée
(6) Ministry of Health, Conakry, Guinea
(7) Service des maladies infectieuses, Hopital Donka, Conakry, Guinée
(8) Institut National de Santé Publique de Guinée, Conakry, Guinée
(9) Mathematical Modelling of Infectious Diseases Unit, Institut Pasteur, Paris, France
† Ces auteurs ont contribué équitablement.
‡ Contribution senior équitable.