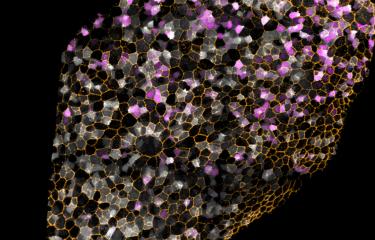
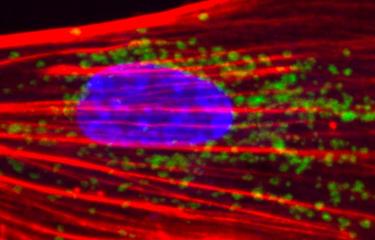
L’enjeu actuel de la médecine régénérative est de reprogrammer des cellules adultes différenciées vers d’autres destins cellulaires pour pallier une déficience. Des chercheurs de l’Institut Pasteur et du CNRS ont montré que les cellules sénescentes, dont l’apparition est traditionnellement associée au vieillissement, au cancer et à l’inflammation, favorisent de manière inattendue la reprogrammation des cellules vers un état plus embryonnaire. L’atteinte de cet état « non différencié » constitue une première étape pour maîtriser la différenciation de cellules pour en remplacer les défectueuses dans le cas d’une pathologie. Ces résultats sont publiés dans la revue Cell Stem Cell, le 22 décembre 2016.
La reprogrammation de cellules adultes est possible depuis 2006 grâce à un cocktail de 4 facteurs important pour la pluripotence, établi par le scientifique japonais Shinya Yamanaka, prix Nobel de médecine 2012 pour cette découverte. Ainsi, des cellules adultes différenciées (cellules cardiaques, neurones, etc.) peuvent revenir à leur état pluripotent, dit stade iPS[1], c’est-à-dire qu’elles seront capables d’engendrer à nouveau n’importe quel type de cellules spécialisées. Depuis dix ans, ces cellules représentent de grands espoirs en médecine régénérative et en thérapie génique, mais le processus de différenciation de ces cellules est encore délicat, et de nombreux progrès restent à faire afin de l’améliorer.
Dans cette étude, les chercheurs du groupe Plasticité cellulaire et modélisation des maladies, dirigé par Han Li et de l’unité Cellules souches et développement, dirigée par Shahragim Tajbakhsh (Institut Pasteur / CNRS), se sont intéressés à la reprogrammation des cellules souches musculaires in vivo, afin de mieux comprendre ce processus et d’identifier de nouveaux facteurs qui pourraient l’améliorer, car le muscle est en principe un tissu très difficilement reprogrammable. En réaction à une lésion musculaire chez la souris, on constate que des cellules dites « sénescentes[2] » apparaissent. Puis, les scientifiques ont induit la reprogrammation des cellules musculaires grâce au cocktail Yamanaka, afin d’obtenir des iPS.
Les chercheurs ont alors comparé le taux de reprogrammation des cellules musculaires en présence ou non de cellules sénescentes. « De manière inattendue, des cellules iPS sont apparues plus efficacement en présence de cellules sénescentes », explique Aurélie Chiche, premier auteur de l’étude. Ils en concluent que la présence de cellules sénescentes a favorisé le processus de reprogrammation vers l’état iPS.
Les scientifiques ont ensuite analysé les molécules sécrétées par les cellules sénescentes. L’interleukine (IL-6), impliquée dans la phase aiguë de l'inflammation, a été identifiée comme étant un facteur favorisant la reprogrammation.
Cette étude montre que la reprogrammation cellulaire peut être favorisée par l’action d’alliés inattendus dont le rôle était jusqu’à présent ignoré : les cellules sénescentes, et en particulier par la sécrétion d’IL-6 par ces cellules.
L’enjeu de ces travaux, qui doivent se poursuivre, est de parvenir à maîtriser le destin des cellules non différenciées ainsi obtenues, afin de les faire se redifférencier vers le type cellulaire souhaité pour des applications en médecine régénérative.
Outre le soutien des institutions mentionnées ci-dessus, cette étude a bénéficié du soutien du LabEx Revive et de l’ERC (European Research Council).
[1] iPS : Induced pluripotent stem cells
[2] Lorsqu'une cellule subit un stress, elle finit par entrer dans un état de sénescence, c’est-à-dire qu’elle ne prolifère plus. Ce type de cellules apparait souvent dans un contexte hostile : vieillissement, cancer, irradiation, agressions extérieures…
Source
Injury-induced senescence enables in vivo reprogramming in skeletal muscle, Cell Stem Cell, 22 décembre 2016
Aurélie Chiche1, 4, Isabelle Le Roux2, 4, Mathieu von Joest1, Hiroshi Sakai2, Sabela Búa Aguín1, Coralie Cazin1, Rana Salam1, Laurence Fiette3, Olinda Alegria1, Patricia Flamant3, Shahragim Tajbakhsh2, *, Han Li1,*,‡
1 Cellular Plasticity & Disease Modelling,
2 Stem Cells & Development,
Dept. of Developmental & Stem Cell Biology, CNRS UMR 3738
3 Human Histopathology and Animal Models
Institut Pasteur, 25 rue du Dr Roux, Paris 75015, France
4 These authors contributed equally and should be considered co-first authors
* Correspondence: Shahragim Tajbakhsh and Han Li
‡ Lead contact