L’analyse de cellules uniques permet d’étudier la diversité d’une population cellulaire d’intérêt et d’en identifier des caractéristiques rares. Elle est particulièrement intéressante dans le cas des cellules du système immunitaire qui produisent les anticorps durant une infection ou après vaccination. Des chercheurs du laboratoire Chimie, biologie, innovation (ESPCI Paris / CNRS) et de l’unité Anticorps en thérapie et pathologie (Institut Pasteur / Inserm) ont mis au point une méthode microfluidique qui permet d’analyser rapidement des dizaines de milliers de cellules uniques. Cette technique, simple à mettre en œuvre et industrialisable, permet de tester la fonctionnalité et l’affinité des anticorps produits pour chaque cellule. Ces travaux pourraient être appliqués rapidement pour l’amélioration de vaccins et le suivi de nouveaux essais vaccinaux, ou d’identifier des anticorps thérapeutiques intéressants plus rapidement. Ces travaux sont publiés en ligne dans la revue Nature Biotechnology.
Après inoculation d’un vaccin, de nombreuses cellules vont être sélectionnées pour produire des anticorps, éléments clés dans la réponse immunitaire. Cette réponse « anticorps » est complexe : les anticorps sont nombreux – il en existe plusieurs dizaines de milliers – et il existe de multiples versions d’un même anticorps, à l’efficacité différente. Par ailleurs, cette population d’anticorps évolue et mature au cours du temps. Suivre l’évolution de cette population en temps réel est donc une tâche difficile, qui était jusqu’à présent inimaginable à réaliser.
Mais le travail conjoint des équipes du laboratoire Chimie Biologie Innovation (ESPCI Paris – CNRS) et de l’unité Anticorps en thérapie et pathologie (Institut Pasteur - Inserm) pourrait représenter une véritable avancée. Jusqu’à présent, les analyses faites pour observer ces phénomènes étaient soit tellement longues que l’analyse était en décalage par rapport à l’évolution de la réponse « anticorps », soit se cantonnaient à calculer une moyenne qui s’affranchit des variations et des informations plus qualitatives sur la fonction et l’affinité des anticorps. Les chercheurs ont justement mis au point un dispositif qui a permis de suivre quotidiennement pendant plusieurs semaines l’évolution d’une population de cellules et les anticorps qu’elles produisaient (500 000 cellules ont ainsi été analysées). Ce test qui consiste à enfermer des cellules uniques dans des gouttelettes et à analyser leurs propriétés par fluorescence, est extrêmement facile à mettre en œuvre et industrialisable.
Les scientifiques de l’Institut Pasteur et du CNRS impliqués ont apporté leur expertise en immunologie, notamment sur un système témoin comme le vaccin antitétanique. HiFiBio, start-up incubée à l’ESPCI Paris, a également participé à ces travaux, notamment dans la perspective d’utiliser cette technologie pour identifier de nouveaux anticorps thérapeutiques.
Prochaine étape : poursuivre le partenariat ESPCI - Institut Pasteur (accord cadre de collaboration signé en 2015) et tester le dispositif sur des réponses immunitaires plus complexes, ainsi que dans le suivi de patients. Les enjeux de santé publique sont primordiaux, puisque ces travaux pourraient permettre de comprendre le rôle des cellules productrices d’anticorps dans certaines maladies (allergies, maladies autoimmunes) ou d’aider au développement de vaccins. Autre débouché important : à travers une collaboration avec le CHU de Montpellier, les chercheurs souhaitent utiliser d’autres types d’analyse sur le même dispositif pour l’étude et le suivi de cellules cancéreuses.
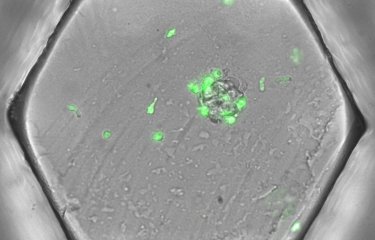
PHOTO : Gouttelettes microfluidiques dans le DropMap. Plusieurs populations de gouttelettes de couleurs différentes sont mélangées afin de voir la sensibilité de la détection. © Klaus Eyer
Source :
Single-cell deep phenotyping of IgG-secreting cells for high-resolution immune monitoring, Nature Biotechnology, 11 septembre 2017
Klaus Eyer, Raphaël C L Doineau, Carlos E Castrillon, Luis Briseño-Roa, Vera Menrath, Guillaume Mottet, Patrick England, Alexei Godina, Elodie Brient-Litzler, Clément Nizak, Allan Jensen, Andrew D Griffiths, Jérôme Bibette, Pierre Bruhns & Jean Baudry
Affiliations
Laboratoire Colloïdes et Matériaux Divisés (LCMD), ESPCI Paris, PSL Research University, CNRS UMR8231 Chimie Biologie Innovation, Paris, France.
Klaus Eyer, Jérôme Bibette & Jean Baudry
Laboratoire de Biochimie (LBC), ESPCI Paris, PSL Research University, CNRS UMR8231 Chimie Biologie Innovation, Paris, France.
Raphaël C L Doineau, Alexei Godina, Elodie Brient-Litzler, Clément Nizak & Andrew D Griffiths
HiFiBio SAS Paris, France.
Raphaël C L Doineau, Luis Briseño-Roa, Vera Menrath & Allan Jensen
Unit of Antibodies in Therapy and Pathology, Department of Immunology, Institut Pasteur, Paris, France.
Carlos E Castrillon, Guillaume Mottet & Pierre Bruhns
INSERM, Paris, France.
Carlos E Castrillon, Guillaume Mottet & Pierre Bruhns
doi:10.1038/nbt.3964