Les cancers du sein post-partum sont diagnostiqués dans les 5 à 10 ans suivant un accouchement. Ils présentent un risque métastatique plus élevé et sont associés à une survie plus faible en comparaison de ceux diagnostiqués chez les femmes n’ayant pas eu de grossesse ou de ceux survenant pendant la grossesse. Une équipe de l'Institut Pasteur a cherché à comprendre les mécanismes impliqués dans la formation de tumeurs au cours de l’involution mammaire, événement majeur de remodelage tissulaire ayant lieu après la grossesse. Les scientifiques révèlent, lors d’une étude préclinique, comment la sénescence – réponse cellulaire entraînant un arrêt stable du cycle des cellules – joue un rôle ambivalent durant l'involution de la glande mammaire. Indispensable au remodelage tissulaire normal de la glande mammaire, la sénescence peut paradoxalement être détournée par les cellules tumorales pour favoriser leur dissémination. Cette découverte, publiée dans Nature Aging, le 18 février 2026, suggère que cibler les cellules sénescentes pendant l'involution pourrait ainsi réduire le risque de cancer du sein post-partum.
L'involution mammaire : un processus de réparation complexe
Après la grossesse puis après l'allaitement, la glande mammaire subit une profonde transformation pour revenir à son état initial. Ce processus, appelé involution post-partum, ressemble au mécanisme de cicatrisation : il implique l'élimination de millions de cellules épithéliales alvéolaires, le recrutement de cellules immunitaires, le remodelage de la matrice extracellulaire, et la repopulation par des cellules adipeuses. C'est un événement physiologique majeur mais aussi un moment critique. L'environnement inflammatoire créé par l'involution augmente de façon transitoire mais significative le risque de développer un cancer du sein post-partum. De plus, les femmes touchées par ce type de cancer présentent un risque de métastase plus élevé et une survie réduite comparée aux femmes diagnostiquées pendant la grossesse ou hors d’une période de grossesse, indépendamment du statut des récepteurs hormonaux exprimés par les cellules cancéreuses mammaires. Notons que ce risque s'accroît avec l'âge maternel, révélant un besoin médical urgent et encore insuffisamment pris en charge en santé des femmes.
La sénescence, cheffe d'orchestre du remodelage tissulaire
En étudiant les glandes mammaires de souris au cours de l'involution, l'unité Plasticité cellulaire dans les pathologies liées à l’âge à l’Institut Pasteur, dirigée par Han Li, a mis en évidence la présence de cellules sénescentes. Les chercheuses ont découvert que la majorité des cellules entrant en sénescence étaient des cellules productrices de lait.
Grâce à un traitement pharmacologique capable de tuer spécifiquement les cellules sénescentes, les scientifiques ont établi que la sénescence est un phénomène crucial pour le déroulement normal de l'involution. En effet, en absence de sénescence, le remodelage tissulaire et la repopulation adipeuse sont retardés. Les travaux de l’équipe du Dr Li révèlent également que les cellules sénescentes sont capables de recruter activement des cellules immunitaires (les macrophages) grâce à des molécules qu’elles sécrètent, orchestrant ainsi le remodelage du microenvironnement.

Ces résultats montrent que la sénescence n'est pas simplement un épiphénomène, mais un acteur clé du remodelage tissulaire complet de la glande mammaire lors de l'involution – une reconstruction remarquable sans cicatrice ou dommage durable
Aurélie ChichePremière auteure de l'étude, chercheuse au sein de l’unité Plasticité cellulaire dans les pathologies liées à l’âge, à l’Institut Pasteur
La sénescence détournée par les cellules cancéreuses
La découverte majeure de cette étude réside dans le rôle paradoxal de la sénescence : si elle est bénéfique pour la réparation tissulaire du sein après la grossesse, elle peut aussi être détournée pour promouvoir la formation de tumeurs. Les scientifiques ont montré que les cellules sénescentes renforcent la plasticité des cellules tumorales via les facteurs qu'elles sécrètent. Ces cellules s’adaptent plus facilement à des changements dans leur environnement, ce qui leur permet de survivre et de se propager dans l’organisme. Dans des modèles murins de cancer du sein, le traitement visant à éliminer les cellules sénescentes pendant l'involution a significativement retardé l'apparition des tumeurs et réduit la formation de métastases.

Nos résultats suggèrent qu'une intervention ciblée visant à modifier les cellules sénescentes pendant l'involution de la glande mammaire pourrait réduire le risque de cancer du sein post-partum
Han LiPrincipale auteure de l’étude, responsable de l'unité Plasticité cellulaire dans les pathologies liées à l’âge à l’Institut Pasteur
Ces découvertes ouvrent la voie à de futures recherches sur des prélèvements de tissus humains. En comprenant mieux comment ces mécanismes pourraient être exploités, les scientifiques espèrent pouvoir développer de futures interventions préventives contre une forme de cancer représentant un besoin médical critique.
Ces travaux ont été financés par l’Institut Pasteur, le CNRS, l’ANR (Laboratoire d’Excellence Revive), et la Fondation ARC pour la recherche sur le cancer.
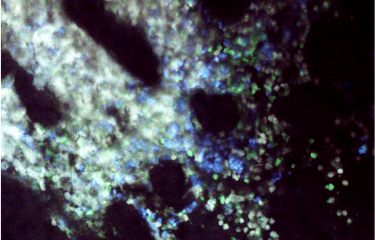
Gauche : Morphologie d’une glande mammaire de souris après marquage permettant de détecter les cellules sénescentes (en bleue).
Centre : Zoom de la partie distale de la glande mammaire.
Droite : Coupe histologique d’une glande mammaire de souris après marquage. Les structures alvéolaires sénescentes sont marquées en bleues. Les canaux qui transportent le lait en rose.
© Institut Pasteur / unité Plasticité cellulaire dans les pathologies liées à l’âge.
Source
Induction of Senescence During Post-partum Mammary Gland Involution supports tissue remodeling and promotes post-partum tumorigenesis, Nature Aging, 18 février 2026
Aurelie Chiche1,#, Lamia Djoual1,#, Elsa Charifou1,2,#, Shuoyang Wang1, Laurianne Temime1, Marielle Saclier1, Shaoxiang Wang1, Jeremy Chantrel1,2, Han Li1,*
1. Cellular plasticity in age-related pathologies, Dept. of Developmental & Stem Cell Biology, CNRS UMR 3738, Université Paris Cité, Institut Pasteur, Paris, France
2. Sorbonne Université, Collège Doctoral, Paris, France
# Contribution égale
* Auteure principale