De nouvelles armes contre les bactéries
Pneumonies, bronchites, otites, méningites, angines, infections urinaires, panaris, septicémies… de très nombreuses infections sont provoquées par des bactéries. Nous avons tous été touchés (et le serons encore…). Nos médecins nous ont alors prescrits des antibiotiques. Ces « armes » de référence contre les bactéries ont sauvé et sauvent encore des millions de vies. Mais leur utilisation et leur emploi abusif chez l'homme comme chez les animaux a conduit à accélérer l’émergence de bactéries résistantes à ces médicaments. L’efficacité des antibiotiques est aujourd’hui est sérieusement menacée. Il y a urgence à en trouver de nouveaux, ou à développer des alternatives pour lutter contre les bactéries pathogènes.
Des infections transitoirement maîtrisées redeviennent graves
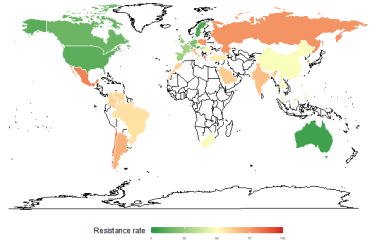
« On risque à l’avenir de ne plus disposer d’antibiotiques permettant de soigner les infections bactériennes courantes », s’alarme l’Organisation mondiale de la santé. Déjà, chaque année en Europe, 400 000 personnes sont infectées par des bactéries multirésistantes aux antibiotiques, dont 158 000 en France. Quand de telles bactéries sont en cause, on peut aujourd’hui mourir d’une infection jugée « banale » - car traitée facilement il y a quelques années (12 500 décès annuels surviennent ainsi en France). Les médecins se retrouvent de plus en plus souvent en situation d’impasse thérapeutique face à certains patients, aucun antibiotique n’ayant plus le moindre effet sur leur infection.
Les chiffres parlent d’eux-mêmes : la résistance des pneumocoques à la pénicilline G était quasiment nulle il y a vingt ans ; 27% des souches de cette bactérie en France y sont désormais insensibles ; dans un cas sur cinq, les infections par le staphylocoque doré acquises à l’hôpital (infections nosocomiales) sont résistantes à l’antibiotique de référence. L’antibiorésistance croissante depuis 10 ans d’une autre bactérie, Escherichia coli, est aussi source d’inquiétude : elle provoque par exemple des infections urinaires – autrefois qualifiées de bénignes - dont beaucoup de patients n’arrivent plus à se débarrasser.
La recherche de nouveaux antibactériens, un défi majeur
L’Institut de veille sanitaire soulignait en novembre dernier à propos de la consommation antibiotique en ville (hors hôpital) : « La France se situe parmi les pays les plus consommateurs en Europe, juste derrière la Grèce. Elle consomme 30 % de plus que la moyenne européenne, 3 fois plus que les pays les plus vertueux. » Or la pression médicamenteuse accélère la sélection de bactéries résistantes. Les autorités de santé tentent donc de diminuer cette consommation pour contenir l’évolution de l’antibiorésistance. Pour freiner la dissémination de ces bactéries à l’hôpital et la contamination des malades, les mesures d’hygiène ont été considérablement intensifiées ces dernières années.
Mais ces initiatives, bien qu’essentielles, ne peuvent que limiter le problème. Les bactéries multi-résistantes sont là. Un des défis majeurs de la recherche biomédicale est de trouver de nouvelles solutions thérapeutiques pour les combattre. Dans les laboratoires, plusieurs pistes sont en cours d’investigation : criblage de nouveaux antibiotiques, conception de nanomédicaments, thérapie par des « virus de bactéries », élaboration d’antibactériens « intelligents »…
De plus, les bactéries pathogènes, même si elles sont individuellement sensibles aux antibiotiques, sont capables d’échapper à leur action lorsqu’elles s’organisent en communauté : elles forment des biofilms à la surface de certains tissus de l’organisme mais aussi sur des matériaux médicaux comme les cathéters ou les prothèses implantables. L’arsenal antibiotique actuel ne parvient pas à détruire ces biofilms et des solutions spécifiques sont à l’étude.
Vous découvrirez dans ce dossier quatre exemples de recherche de nouveaux antibactériens, quatre angles d’attaque très différents contre les bactéries pathogènes, et un seul objectif : doter la médecine de nouvelles armes pour combattre les infections bactériennes.
Face au problème croissant de l’antibiorésistance, si la recherche de nouveaux antibiotiques est indispensable, des initiatives visent également à les administrer différemment, par exemple en les enrobant dans des nanoparticules, un assemblage de lipides ou de sucres. Cette formulation aurait l’avantage de délivrer les antibiotiques à des doses inférieures, ce qui freinerait l’apparition des résistances et permettrait d’utiliser des molécules aujourd’hui délaissées car mal tolérées. Le projet NAREB (Nanotherapeutics for Antibiotic Resistant Emergent Bacterial pathogens), lancé en février 2014 et coordonné à l’Institut Pasteur, associe 15 laboratoires dans huit pays d’Europe autour d’un objectif commun : développer des nanomédicaments contre deux types d’infections très préoccupantes, celles dues au staphylocoque doré résistant à la méthicilline (SARM) et la tuberculose multi-résistante. Les SARM sont des causes fréquentes d’infections nosocomiales sévères : les personnes touchées ont un risque de décès supérieur de 64% à celui des personnes atteintes d’une forme non résistante de l’infection. Quant à la tuberculose multi-résistante, près de 480 000 personnes l’ont développé en 2014, et presque un dizième de ces cas seraient des infections « ultra-résistantes » - signalées dans une centaine pays et contre lesquelles même les antibiotiques de deuxième intention sont inefficaces.
Tuberculose : une situation dramatique

Pr Brigitte Gicquel, coordinatrice du projet européen NAREB et responsable de l’unité de Génétique mycobactérienne à l’Institut Pasteur.
La situation de la tuberculose est d’autant plus dramatique qu’une toxicité plus élevée que prévue de la seule nouvelle molécule permettant de traiter les cas graves de tuberculose multirésistante, la bédaquiline, a été constatée... L’arrivée de nouveaux médicaments et de formulations innovantes est donc plus attendue que jamais.
« Devant le désengagement de la plupart du secteur industriel, nous, laboratoires académiques, devons faire un effort pour trouver de nouveaux antibiotiques en partenariat avec les sociétés pharmaceutiques restant encore impliquées », ajoute le Pr Brigitte Gicquel, spécialiste de la tuberculose qui, parallèlement au projet NAREB, participe à différents programmes internationaux. Son laboratoire travaille à la recherche de nouveaux antibiotiques contre le bacille de la tuberculose par des méthodes de criblage moléculaire, en collaboration avec Hélène Munier-Lehmann (unité de Chimie et biocatalyse, Institut Pasteur). et avec l’Institut Pasteur de Shanghai. Des recherches cruciales face à une maladie qui est aujourd’hui la plus meurtrière des infections dues à un agent pathogène unique (devant le sida et le paludisme): 9,6 millions de personnes – dont plus d’un million d’enfants - ont développé une tuberculose en 2014 et 1,5 million en sont mortes, d’après l’Organisation mondiale de la santé. Actuellement 3,7% des nouveaux cas de tuberculose dans le monde et 20% des cas déjà traités sont des cas de tuberculose multi-résistante, complexifiant une prise en charge déjà lourde pour une tuberculose « sensible » (un traitement de plusieurs mois avec quatre antibiotiques)…
Utiliser les ennemis naturels des bactéries
De plus en plus de chercheurs se penchent avec des méthodes d’investigation modernes sur une thérapie lancée au début du XXe siècle, avant la découverte des premiers antibiotiques. Elle consiste à attaquer et détruire les bactéries avec leurs ennemis naturels : des « virus de bactéries » appelés bactériophages, qui sont chacun spécifique d’une bactérie donnée, n’infectant donc que la bactérie hôte sans détruire, par exemple, la flore microbienne.
En 1917 à l’Institut Pasteur, Félix d’Hérelle décrit pour la première fois le phénomène de destruction des bactéries par les bactériophages et rapporte le premier essai expérimental de « phagothérapie ». Deux ans plus tard cette nouvelle thérapie est appliquée à l’homme alors qu’on ne dispose d’aucune arme contre les bactéries, responsables de nombreuses maladies infectieuses et d’innombrables décès. Des solutions de bactériophages sont commercialisées et la phagothérapie connaît un âge d’or jusqu’à l’arrivée des antibiotiques en médecine au début des années 1940, des molécules chimiques que l’industrie peut facilement standardiser. Seuls certains pays de l’Est ont continué à l’utiliser jusqu’à nos jours. Mais le standard des études cliniques actuel ne correspond plus à celui des années passées et il faut donc réévaluer l’efficacité thérapeutique de ces « virus guérisseurs ».


Une alternative à évaluer en clinique
A l’Institut Pasteur, le groupe de Laurent Debarbieux dans le département de Microbiologie travaille depuis plusieurs années sur les bactériophages et a récemment démontré leur efficacité, au laboratoire, contre deux types d’infections pulmonaires. « Nous cherchons avant tout à démontrer le potentiel thérapeutique des bactériophages dans le traitement d’infections provoquées par des bactéries résistantes aux antibiotiques », précise le chercheur. Une partie de ses travaux s’est focalisée sur la bactérie Pseudomonas aeruginosa, responsable d’infections pulmonaires dont souffrent fréquemment les personnes atteintes de la mucoviscidose, et cause majeure de décès chez ces patients. L’un des enjeux était de vérifier la capacité des bactériophages à agir à travers l’abondant mucus qui envahit le système respiratoire des malades. « Nous avons prouvé au laboratoire, sur des modèles expérimentaux, l’efficacité d’un cocktail de 10 bactériophages à infecter les souches de P. aeruginosa nichées au sein des sécrétions pulmonaires des patients », explique Laurent Debarbieux. « En coordination avec une association de patients et des cliniciens*, nous discutons actuellement la mise en place d’un essai clinique.»
Un autre axe de travail consiste à cibler des souches d’E. coli (une bactérie dont l’antibiorésistance augmente dramatiquement) responsables de pneumonies chez des patients en réanimation. L’équipe a montré au laboratoire qu’une seule application d’un type unique de bactériophage était aussi efficace qu’un traitement antibiotique de référence.
« Aujourd’hui, nous avons besoin d’essais cliniques pour évaluer ces approches thérapeutiques », souligne Laurent Debarbieux. « Un essai européen est en cours pour tester la phagothérapie dans les infections à E. coli et P. aeruginosa chez les grands brulés. Nos résultats justifient aujourd’hui le lancement d’autres essais cliniques, malgré une règlementation plus complexe avec les bactériophages qu’avec des substances inertes. »
*L’équipe collabore avec des cliniciens des hôpitaux parisiens Necker, Bichat et Louis Mourier et l’hôpital CHRU de Montpellier.
Au-delà du problème de l’antibiorésistance, les antibiotiques ont un défaut majeur : ils s'attaquent sans distinction aux bonnes et aux mauvaises bactéries. On sait notamment qu’ils détruisent en partie les bactéries de notre microbiote, essentielles au bon fonctionnement de notre organisme. De récentes avancées biotechnologiques ont permis la conception d’armes totalement nouvelles qui cibleraient uniquement les bactéries néfastes.
Des « robots » biologiques
Pour cela, les chercheurs utilisent des bactériophages, ces « virus de bactéries » à l’origine d’une thérapie alternative aux antibiotiques, la phagothérapie. Mais il ne s'agit pas ici d'administrer ces virus antibactériens tels quels. Grâce à l’ingénierie génétique, les chercheurs sont capables de les transformer en véritables petits robots biologiques tueurs de bactéries bien précises. Comment ? Seule l’enveloppe du bactériophage – la « capside » - est utilisée. L’intérêt est qu’elle peut entrer dans des bactéries, mais pas dans les cellules humaines. Cette capside va donc servir à délivrer un « circuit génétique » aux bactéries néfastes : il comprend des ciseaux moléculaires couplés à un « guide » qui va cibler exclusivement un petit morceau d’ADN défini de la bactérie visée, au sein d’un gène de résistance ou de virulence. Le bactériophage a été transformé en cheval de Troie : il injecte le circuit dans la bactérie, le programme génétique se met en marche. Le ciseau « scanne » l’ADN. S’il trouve le fragment de gène, il coupe. La bactérie meurt. S’il ne le trouve pas, il n’y a rien à couper. La bactérie survit.
Retrouvez David Bikard, responsable du groupe Biologie de synthèse à l’Institut Pasteur, qui explique les antibiotiques intelligents pour éliminer les bactéries de façon ciblée, sur la chaîne Youtube de l'Institut Pasteur.
Les chercheurs ont appelé ces nouveaux outils antibactériens « éligobiotiques », eligo signifiant en latin choisir ou trier… « Chaque bactériophage étant spécifique d’une bactérie donnée, il nous faut fabriquer les éligobiotiques à partir de différentes capsides selon les bactéries ciblées », précise David Bikard, responsable du groupe Biologie de synthèse à l’Institut Pasteur. « Avec les éligobiotiques, c’est la première fois qu’on peut éliminer des bactéries de façon aussi ciblée », souligne le chercheur. « Ils ne sont pas pour autant destinés à supplanter les antibiotiques. Ils ne seront jamais aussi efficaces et aussi rapides qu’une molécule antibiotique classique. Mais ils pourraient être très utiles chez des personnes infectées par des bactéries multi-résistantes aux antibiotiques. D’autres utilisations sont possibles. On sait par exemple que des déséquilibres du microbiote sont à l’origine de beaucoup de maladies. Des éligobiotiques pourraient permettre de rétablir l’équilibre en détruisant des bactéries néfastes du microbiote. »
NB : L’équipe collabore avec des cliniciens des hôpitaux parisiens Necker, Bichat et Louis Mourier, et avec l’hôpital CHRU de Montpellier.
Acné et maladie de Crohn
David Bikard est aussi directeur scientifique de la start-up Eligo Bioscience, incubée à l’Institut Pasteur, qui vise à développer des traitements par éligobiotiques, en premier lieu contre l’acné et la maladie de Crohn. Dans le cas de l’acné, les antibiotiques actuels ne font pas de distinction entre les bactéries P. Acnes utiles et celles qui provoquent la maladie de peau, ce qui génère d’importants effets secondaires. Quant à la maladie de Crohn, elle pourrait être en partie liée à un déséquilibre du microbiote intestinal. Dans un cas comme dans l’autre, il s’agit de cibler très spécifiquement certaines populations de bactéries.
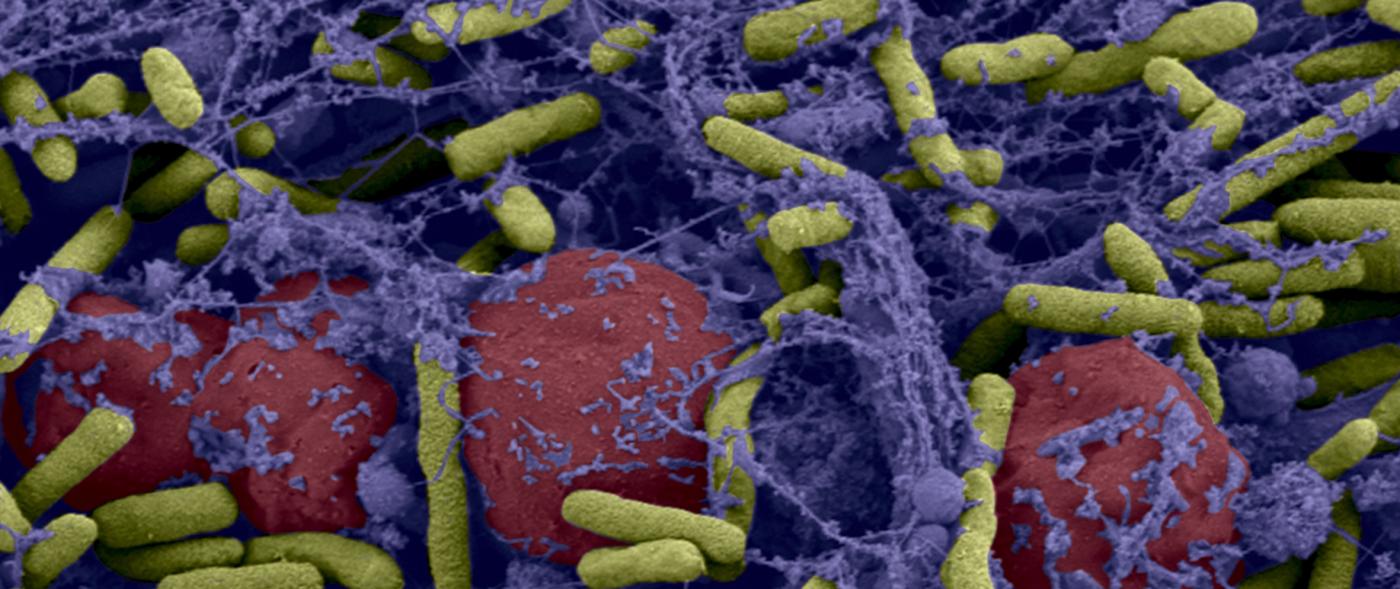
Quand les bactéries vivent en communauté, il est encore plus difficile de s’en débarrasser. Or sur nos tissus, sur des cathéters, sur des prothèses, les bactéries peuvent former des « biofilms » : elles adhèrent à la surface, secrètent une gangue – la matrice -, se multiplient et s’agrègent les unes aux autres pour former une masse pouvant contenir des millions de milliards de bactéries. Comme l’union fait la force, ces biofilms bactériens deviennent « tolérants » aux antibiotiques : même si individuellement les bactéries qui les composent sont sensibles aux antibiotiques, ces médicaments n’ont plus d’effet contre elles lorsqu’elles sont organisées en biofilm (le problème est bien sûr amplifié si un biofilm est composé de bactéries résistantes). La médecine est aujourd’hui démunie face à ces communautés bactériennes et la lutte contre les biofilms est devenue un enjeu de taille pour la recherche biomédicale. Surtout quand on sait qu’ils seraient impliqués dans 60% des infections acquises à l’hôpital (infections nosocomiales).
Photo ci-dessus : Biofilm de bactéries Pseudomonas aeruginosa formé dans un catheter central. En jaune Pseudomonas aeruginosa et en rouge des cellules sanguines. © Institut Pasteur/A. Chauhan, JM Ghigo, C. Beloin. Photo réalisée par Laboratoire de Biologie Cellulaire - Microscopie Electronique, Faculté de Médecine de Tours. Colorisation JM Panaud.
Des chambres implantables aux prothèses
L’équipe de Jean-Marc Ghigo à l’Institut Pasteur (unité de Génétique des biofilms) est spécialisée dans l’étude des biofilms, analysant leur formation et les différents aspects du mode de vie en communauté des bactéries. Le chercheur précise le mécanisme qui empêche les antibiotiques d’être efficaces : « Si un antibiotique agit sur un biofilm, beaucoup de bactéries vont être tuées, mais certaines bactéries qu’on nomme "persistantes" vont survivre au traitement, et permettre la reformation du biofilm ». Heureusement, des solutions se profilent. L’équipe pasteurienne a mené en collaboration avec des cliniciens* une étude sur les chambres implantables, ces petits boîtiers installés sous la peau qui permettent l’administration de médicaments, notamment en cas de chimiothérapie anticancéreuse. « Ces chambres sont infectées par des biofilms dans 4 à 5% des cas », explique Jean-Marc Ghigo. « Quand une infection est suspectée, elles doivent être retirées, ce qui n’est pas un acte anodin, surtout chez des patients fragilisés ». Aujourd’hui, entre deux utilisations de la chambre, un « verrou » antibiotique est appliqué pour limiter le phénomène de formation des biofilms ; il consiste à injecter dans la chambre un faible volume d’antibiotiques. « Nous souhaitons mettre au point un verrou "curatif" capable de supprimer efficacement d’éventuels biofilms dans ces chambres implantables. Pour cela, nous couplons un antibiotique classiquement utilisé à une molécule qui s’attaque à la matrice des biofilms tout en augmentant la pénétration de l’antibiotique dans les bactéries persistantes. Nous avons prouvé au laboratoire l’efficacité de ce mélange ». Ce nouveau « verrou » antibactérien est actuellement en fabrication par les Hospices Civils de Lyon en vue de futurs essais cliniques. Une autre piste est à l’étude dans l’unité : il s’agit cette fois de prévenir la formation des biofilms. « On "greffe" sur des surfaces une molécule qui les rend « glissantes » et empêche ainsi aux bactéries d’adhérer, de s’attacher à ces surfaces », explique le chercheur Christophe Beloin, qui mène toutes ces expérimentations avec Jean-Marc Ghigo. « Pour l’instant, il est difficile d’avoir un effet à long terme avec cette stratégie. Mais elle pourrait être utilisée sur le court terme, lors de la pose d’une prothèse par exemple ».
*L’unité de Génétique des biofilms collabore avec David Lebeaux de l’hôpital Necker et de l’hôpital européen Georges-Pompidou à Paris, et avec des cliniciens de l’hôpital Dupuytren à Limoges.