Décrypter les mystères du cerveau
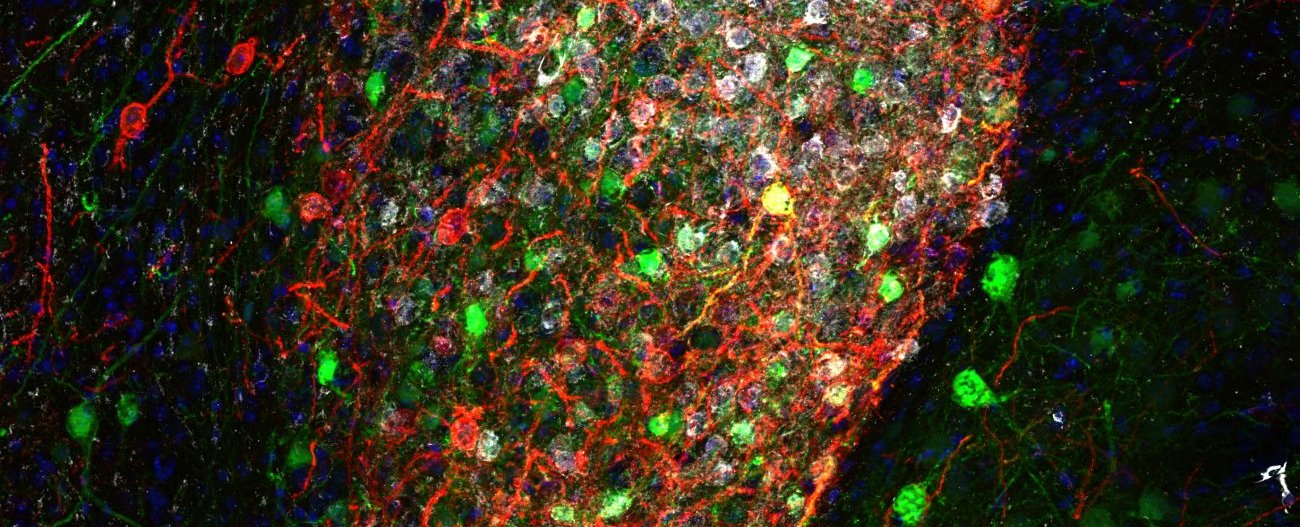
Crédit : Institut Pasteur/Ferdinand Jagot
Chef d’orchestre de l’organisme, le cerveau gère de nombreuses fonctions vitales. Il est aux commandes du langage et de nos mouvements. Il est le siège de notre conscience, notre intelligence, notre mémoire, nos émotions, pensées et perceptions. Cependant, si nous le comprenons de mieux en mieux, le cerveau reste en grande partie mystérieux. À l’Institut Pasteur, des équipes cherchent donc à comprendre le fonctionnement normal du cerveau, et à expliquer ses éventuels dysfonctionnements ou certaines pathologies cérébrales. Les maladies de la connectivité cérébrale et les maladies neurodégénératives constituent l'un des axes prioritaires du Plan stratégique 2019-2023 de l'Institut Pasteur.
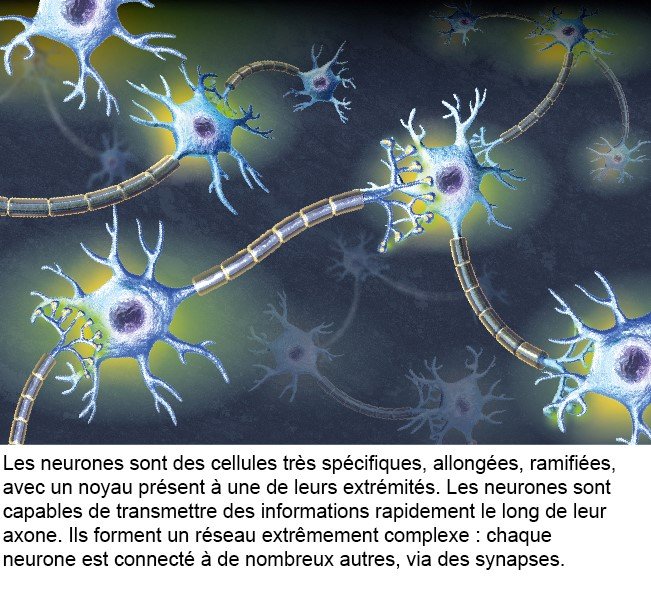
Il y a 80 milliards de cellules nerveuses dans le cerveau, presqu'autant que de planètes dans la Voix Lactée* (source : The remarkable, yet not extraordinary, human brain as a scaled-up primate brain and its associated cost, PNAS). Ces cellules peuvent êtres des neurones, mais aussi des cellules gliales qui entourent les neurones et participent au contrôle de l’environnement chimique et électrique en leur fournissant des nutriments et en éliminant leurs déchets. Ces cellules échangent des informations entre elles au niveau des synapses (voir infographie), l’extrémité des neurones qui est connectée aux autres neurones.
*Correction au 9 septembre 2024 : nous avions écrit précédemment "presqu'autant que d’étoiles dans l’univers" au lieu de "presqu'autant que de planètes dans la Voie Lactée..." (au moins 100 milliards de planètes dans notre galaxie). Merci à nos fidèles lecteurs pour l'erreur signalée.
Le cerveau, un organe éminemment connecté
Comment se mettent en place de ces circuits cérébraux avant la naissance ? Comment sont-ils modifiés au cours de la vie ? Comprendre ces mécanismes est primordial pour appréhender les maladies liées au cerveau. En effet, pour presque toutes ces maladies et troubles, il y a une modification dans la communication entre certains neurones et les autres cellules, ainsi qu’entre le cerveau et le reste du corps. De nombreux centres de recherches à travers le monde, dont l’Institut Pasteur, s’activent dans ce sens : « À l'instar du décryptage du génome humain, les scientifiques se lancent aujourd'hui collectivement dans une entreprise plus ambitieuse et plus complexe visant à cartographier les connexions du cerveau et à comprendre comment le code de l'activité électrique est utilisé par le cerveau pour percevoir et traiter les informations et générer des mouvements, le langage et la pensée », explique David Digregorio, responsable du laboratoire Dynamique des synapses et des circuits neuronaux à l’Institut Pasteur.
Le cerveau, un organe complexe en interaction avec son environnement

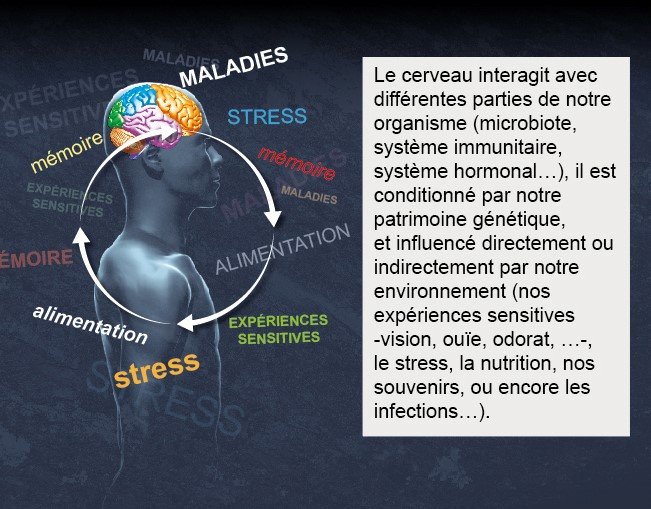
1 - Le cerveau dans son environnement
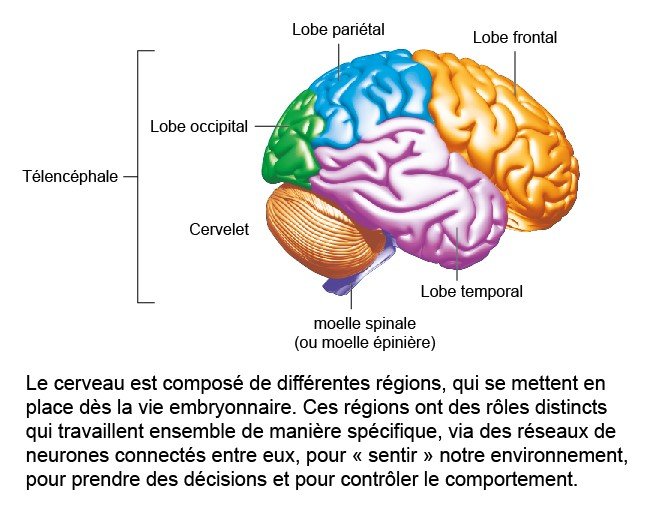
2 – Les grandes zones du cerveau
3- Les neurones et leur rôle
4- Les synapses et leur rôle


Seule une approche multidisciplinaire nous permettra de comprendre les maladies du cerveau et de développer des thérapies innovantes.
Connait-on la façon dont est structuré le cerveau ?
David Digregorio : Le cerveau est composé de nombreuses sous-régions. Celles-ci ont traditionnellement été associées à des comportements spécifiques : traitement des informations visuelles, contrôle des mouvements, sensation de faim, navigation dans l'espace et même l'influence d'émotions telles que la peur. Cependant, il est de plus en plus évident que l'activité cérébrale qui sous-tend le comportement implique de multiples régions, comprenant des réseaux de cellules nerveuses qui sont connectées par des synapses.
Contrairement aux circuits électriques, les connexions entre neurones sont plastiques et peuvent modifier la force de leur connectivité, ou capacité à transmettre des informations. De plus, le cerveau a développé ses extraordinaires capacités cognitives au sein d'un corps qui détecte le monde qui l'entoure. Le cerveau assure la survie de cet organisme grâce à une communication avec d'autres systèmes du corps : immunitaire, digestif, hormonal ou endocrinien et cardiovasculaire par exemple. On pense donc que les déficiences de la connectivité au sein du cerveau, ou entre celui-ci et le corps, sont à l'origine de maladies neurologiques, neurodégénératives et psychiatriques.
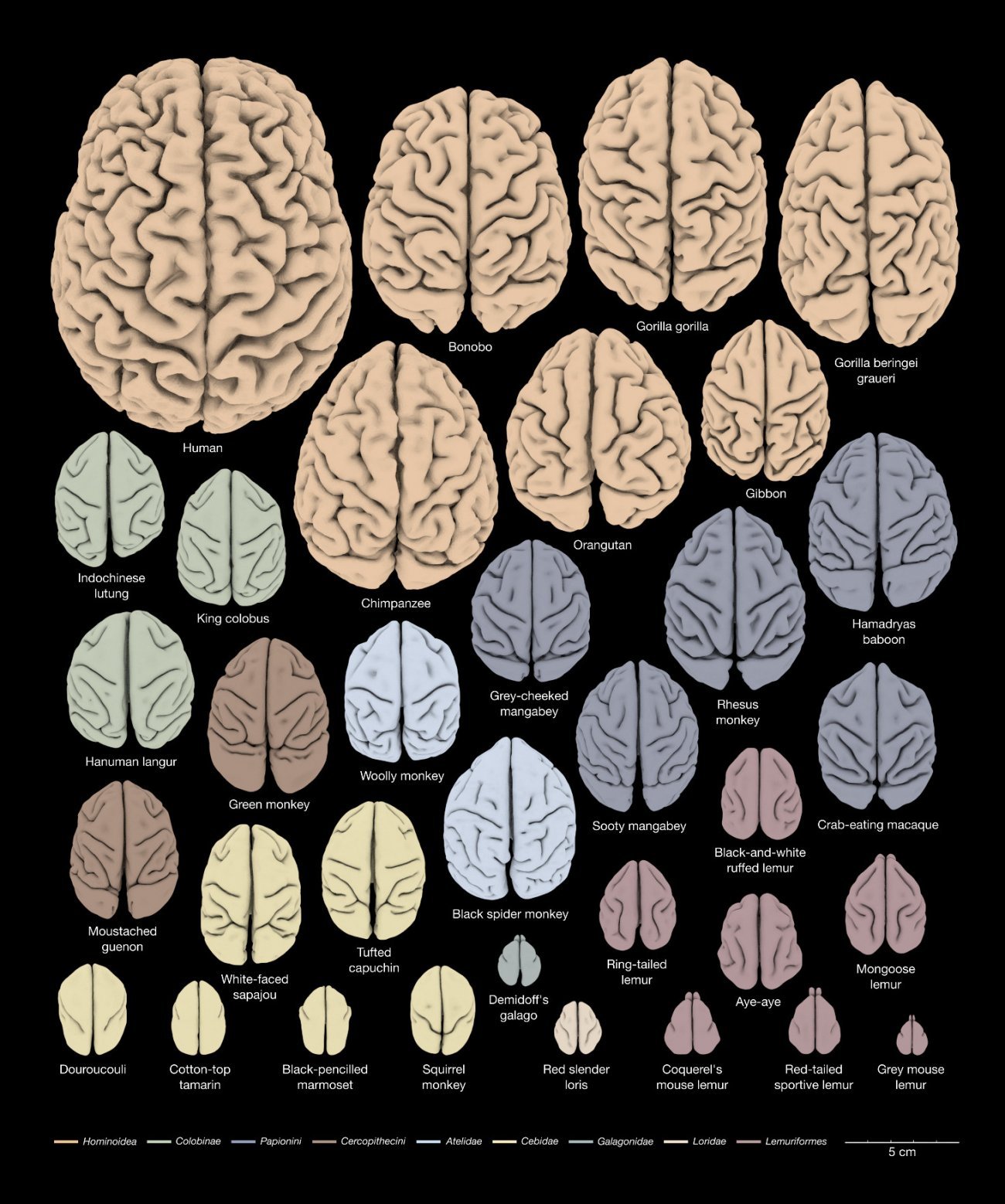
Une caractéristique particulière du cerveau humain, par rapport aux autres espèces de mammifères, est la taille relativement importante de la région néocortex du cerveau [voir infographie]. Le néocortex est associé à de nombreuses fonctions cognitives, notamment la production et la compréhension du langage.
Vous dites que le cerveau communique avec d’autres parties du corps. De quelle manière ?
David Digregorio : Le cerveau n'est pas un organe isolé mais est « connecté », soit par des connexions nerveuses électriques directes, soit par des signaux chimiques tels que les hormones, à d'autres parties du corps qui peuvent influencer des fonctions corporelles essentielles comme la faim et la satiété ou même l'humeur. Le fonctionnement du cerveau peut être influencé par l'état du microbiome au sein de l'appareil digestif ainsi que par les systèmes immunitaire et inflammatoire. Ainsi, comme nous l'avons expérimenté récemment lors de la pandémie, même les infections microbiennes peuvent influencer directement la fonction cérébrale et le comportement. L’Institut Pasteur a tiré parti de la présence de multiples disciplines de recherche pour établir une approche plus holistique de l'étude de l’influence de la connectivité cerveau-corps sur la fonction et le dysfonctionnement du cerveau.
Quelles autres recherches ont lieu à l’Institut Pasteur sur le cerveau ?
Chiara Zurzolo : Depuis 2019, la direction de l'Institut Pasteur a établi un axe prioritaire de recherche sur « les maladies de la connectivité cérébrale et les maladies neurodégénératives ». L’enjeu est de tirer parti des atouts de l’Institut en recherche fondamentale dans les neurosciences, la génétique, la biologie cellulaire et le développement, l'immunologie, la microbiologie et la biologie des infections, afin d'améliorer la compréhension de la complexité de la fonction cérébrale et des troubles qui y sont associés. Ce programme est dirigé par David Digregorio, neuroscientifique, et moi-même, biologiste cellulaire, et nous avons un comité directeur qui comprend des biologistes du développement, des immunologistes et des biologistes cellulaires, ainsi que des neuroscientifiques de différents domaines.
Ce soutien à nos recherches, inscrit dans le plan stratégique de l’Institut Pasteur, est une occasion unique pour l'Institut de mettre son expertise scientifique au service de grandes questions en neuroscience : comprendre comment le cerveau fonctionne, décrypter ce qui ne va pas dans des maladies comme Alzheimer, Parkinson, l'autisme ou encore la schizophrénie, et enfin mettre au point des traitements innovants. L'échec de nombreux essais cliniques coûteux souligne la nécessité d'une compréhension plus approfondie des mécanismes des maladies et d'un changement d'approche. Seule une vision multidisciplinaire nous permettra de comprendre les maladies du cerveau et de développer des thérapies innovantes.
Comment fonctionne le cerveau ?
Les chercheurs ont besoin de comprendre le fonctionnement du cerveau, pour en soigner les pathologies. Les origines des maladies sont très variées, il est donc essentiel d’étudier tout organe, y compris le cerveau, à diverses échelles : de la molécule jusqu’au corps tout entier et à l’environnement qui l’entoure.
Le laboratoire Dynamique des synapses et circuits neuronaux de l’Institut Pasteur s’est lancé un défi ambitieux : comprendre comment le comportement émerge des processus biologiques générés par les molécules, les synapses, les neurones et les ensembles des neurones connectés appelés circuits neuronaux. David Digregorio, responsable de ce laboratoire, explique : « Nous cherchons à comprendre comment le temps subsecondaire [de moins d’une seconde] est encodé dans le cerveau pour générer des mouvements habiles, afin d'interagir avec l'environnement externe (par exemple, attraper une proie ou jouer du piano). Pour ce faire, nous émettons l'hypothèse que le cerveau a évolué vers des horloges internes ». Les chercheurs de cette équipe ont démontré en 2019 le rôle de l'organisation, à l'échelle nanométrique, des molécules au niveau des synapses dans la diversité de la communication entre neurones. Cette caractéristique des synapses semble également permettre la représentation du temps et son utilisation pour générer des mouvements précis.
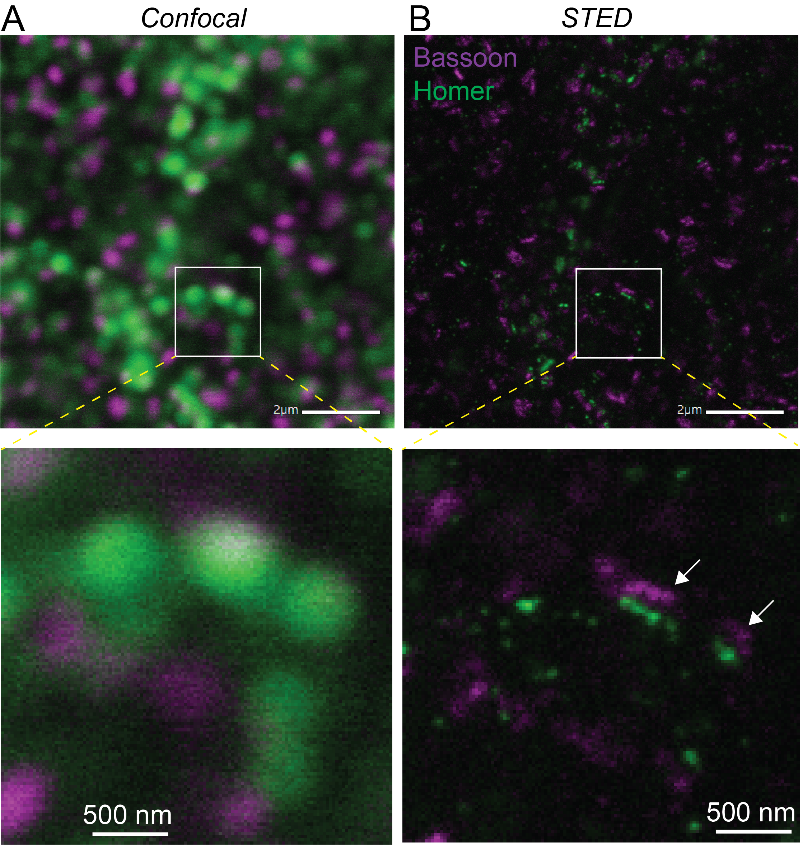
Les microscopes sont un outil indispensable aux biologistes. Ils leur permettent d’observer les cellules, la composante vivante fondamentale des organismes biologiques, ainsi que de nombreux processus fondamentaux de la vie qui sont invisibles à l'œil humain.
La taille des cellules varie de 1 à 50 millionièmes de millimètre. Mais les molécules qui les composent, et sont responsables de nombreuses réaction chimiques indispensable au vivant, font une taille plus proche d'un nanomètre ou moins. Deux types de microscopes sont donc nécessaires pour observer les phénomènes vivants : La microscopie optique peut observer des processus jusqu'à un peu moins d'un demi-micromètre, soit 500 nanomètres. En revanche, les microscopes électroniques sont nécessaires pour voir les structures cellulaires jusqu'à l'échelle des molécules uniques et, dans certains cas, jusqu'à l'échelle atomique.
En-dehors de ces deux microscopes classiques, deux nouvelles techniques permettent de toujours mieux visualiser le vivant. La microscopie de fluorescence à super-résolution (et récompensée par le prix Nobel en 2014) permet aux neuroscientifiques d'observer les processus et l'organisation moléculaires du cerveau jusqu'à l'échelle de 10 nanomètres. En 2017, un prix Nobel a été attribué à la microscopie cryo-électronique, une technologie extraordinaire qui permet de visualiser des protéines uniques au sein des cellules et même la structure des protéines elles-mêmes. À l'Institut Pasteur, les chercheurs ont accès à ces deux technologies, qui offrent une vue détaillée sans précédent au sein des synapses et des cellules du cerveau. D'autres technologies existent comme le microscope Titan KriosTM, un microscope électronique doté de capacités hors norme (lire plus bas l'utilisation de Titan KriosTMdans l'étude du Covid long).
Malgré toutes ces avancées, la capacité d'observer les cellules cérébrales dans leur environnement naturel est entravée par les propriétés opaques du tissu cérébral. Pour contourner cette limitation, les neuroscientifiques utilisent une technologie est appelée microscopie de fluorescence à excitation multiphotonique. Cette méthode de microscopie a révolutionné notre compréhension du comportement des neurones individuels et des réseaux de neurones dans des échantillons expérimentaux et, dans certains cas, au cours du comportement animal. Cette technologie est bien établie dans plusieurs laboratoires et équipements partagés de l'Institut Pasteur.
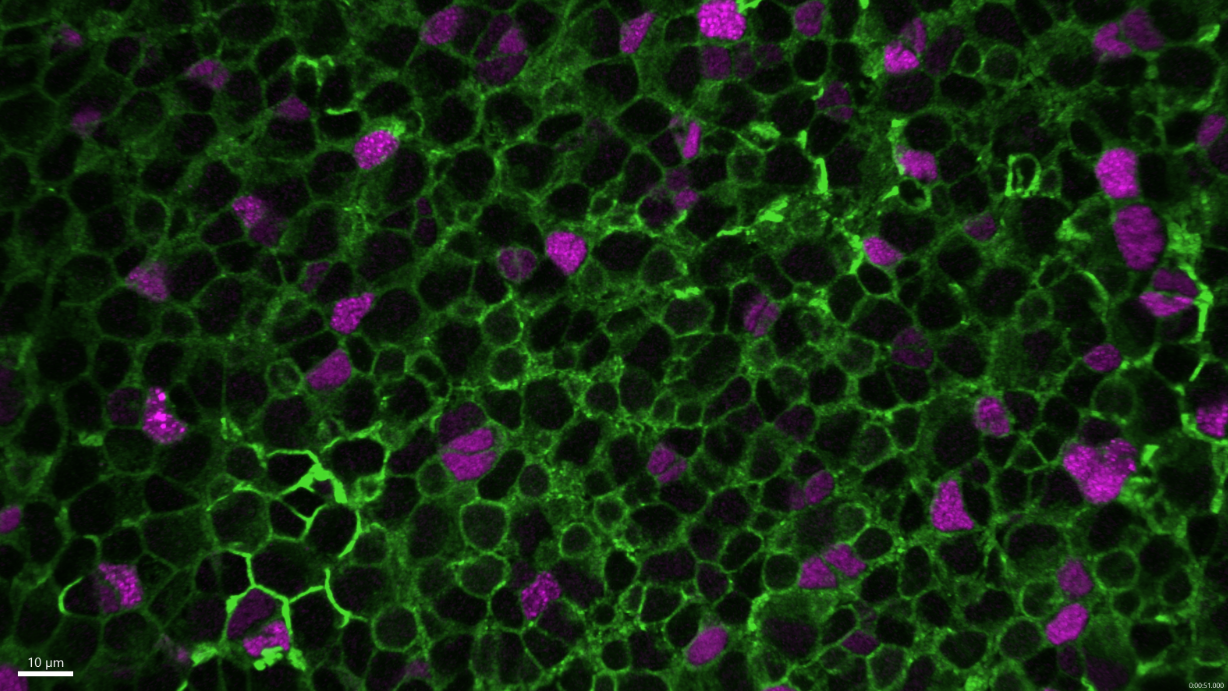
Cellules souches neurales (cerveau de poisson zèbre) imagées au microscope confocal. Crédit : Institut Pasteur/Nicolas Dray, Laure Mancini, Laure Bally-Cuif
Comment se développe le cerveau ?
La première étape de la formation du cerveau a lieu chez le fœtus, vers le 19e jour de la grossesse, lorsque les cellules s’organisent en une plaque puis un tube neural. Cette plaque provient d’un ensemble de cellules de l’embryon, appelés feuillet neuroectodermique. A cette étape, le cerveau est en devenir, il n'est pas encore mature ni pour donner des instructions ni pour recevoir des informations.
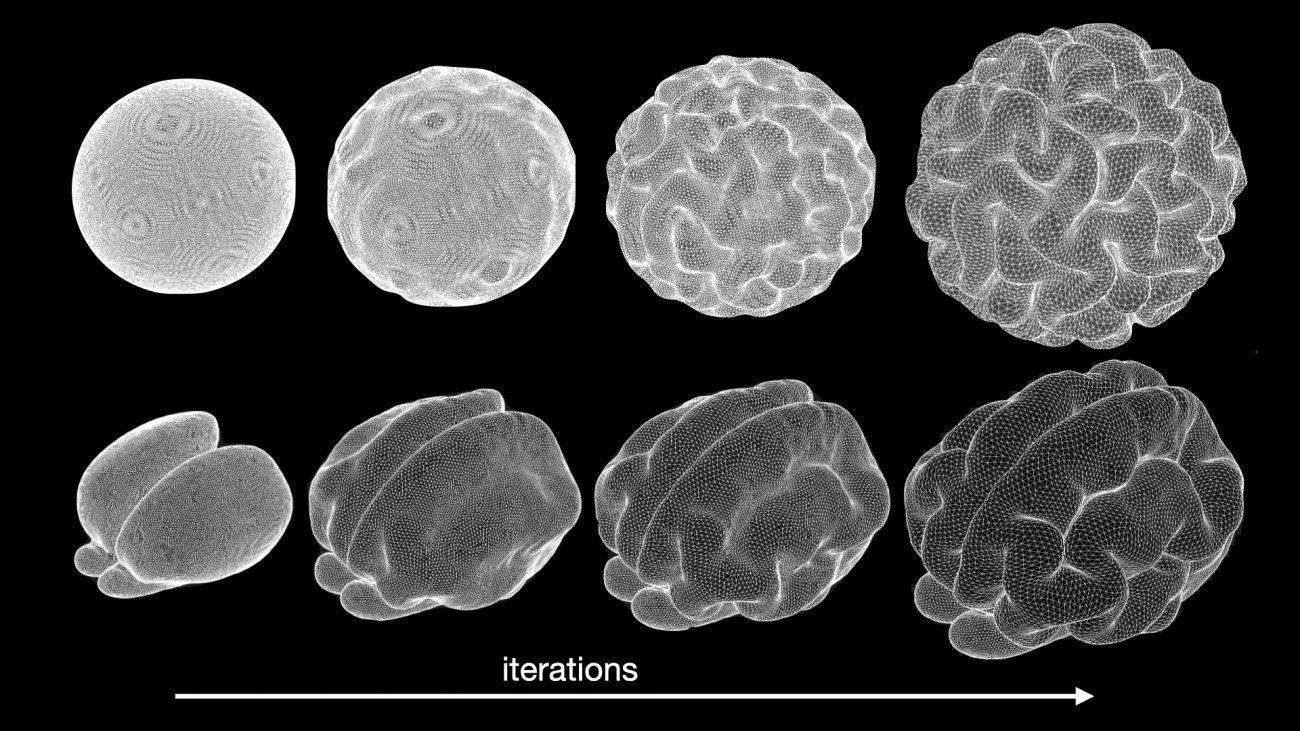
« Il y a des étapes de régulations, d’interactions et de migrations cellulaires qui font que l’embryon, initialement une boule, va identifier une région prédéfinie pour constituer le cerveau », précise Laure Bally-Cuif, responsable du laboratoire Neurogénétique du poisson zébré à l’Institut Pasteur. Les cellules de ce territoire vont ensuite se multiplier et la région va grossir, puis se régionaliser : la structure acquiert une orientation, c’est-à-dire un avant et un arrière. Des subdivisions supplémentaires à l’intérieur de cette région vont ensuite contribuer à créer des territoires cérébraux et chacun de ces territoires acquiert une identité différente. Les zones frontières créées entre chaque territoire sont cruciales pour la régionalisation fine du cerveau, car elles sont sources de signaux qui ont des propriétés organisatrices. « A ce stade de développement, l’organisation du cerveau de toutes les espèces vertébrées se ressemble. On peut à peine faire la différence entre le cerveau d’une souris, d’un poisson, d’une tortue ou d’un poulet ! », souligne Laure Bally-Cuif.

Aux premiers stades de développement, l’organisation du cerveau de toutes les espèces vertébrées se ressemble. On peut à peine faire la différence entre le cerveau d’une souris, d’un poisson, d’une tortue ou d’un poulet !
Laure Bally-CuifResponsable du laboratoire Neurogénétique du poisson zébré à l’Institut Pasteur
Une fois ces territoires créés, la neurogenèse a lieu. Il s’agit de la différenciation progressive des cellules, qui sont encore des cellules progénitrices, au sein de ces territoires. Les cellules progénitrices deviennent soit des neurones, soit l’autre type de cellules présentes dans le cerveau : les cellules gliales. En se différenciant, ces cellules acquièrent des propriétés fonctionnelles : elles vont pouvoir remplir leurs différents rôles. Cependant, certaines cellules restent au stade progéniteur et persistent à long terme. Celles-ci vont permettre à de nouveaux neurones de voir le jour, même à l’âge adulte. On les appelle les cellules souches. La manière dont ces cellules sont sélectionnées, et le maintien de leurs propriétés jusqu’à l’âge adulte, restent encore mal comprises.
Pendant la neurogenèse, des neurones différents sont produits dans chaque territoire cérébral. C’est alors que les cerveaux des vertébrés commencent à différer les uns des autres, surtout au niveau de la morphologie et de la taille. Par exemple, chez l’homme, le cortex est beaucoup plus important que les autres territoires cérébraux. Chez le poisson, c’est le cervelet qui grossit le plus au cours du développement.
Comprendre les zones frontières du cerveau et leurs rôles dans les maladies
L’ensemble de ces processus précoces du développement cérébral sont très sensibles à de nombreux facteurs (génétiques, toxines, infections…). Leurs anomalies sont à l’origine de syndromes neurodéveloppementaux, dont certains peuvent être très graves, affectant la taille du cerveau, ou sa fonction par exemple dans le contrôle du comportement.
Le développement du cerveau s’effectue également en interaction avec les autres tissus et organes en formation.
« Le plexus choroïde que nous étudions, est à l’interface entre le sang et le système nerveux et permet un dialogue entre ces tissus : il peut recevoir des signaux de l’extérieur et produire des facteurs qui vont influencer le cerveau » explique Aleksandra Deczkowska, chercheuse dans le groupe Interaction cerveau-immunité à l’Institut Pasteur.
Le plexus choroïde est également impliqué dans le vieillissement : avec l’âge, il commence à produire des signaux antiviraux, ce qui a un impact négatif sur le cerveau.
L’autisme, des troubles hétérogènes avec une composante génétique
Avec plus de 650 000 personnes concernées enfance, l’autisme est très hétérogène mais il est défini par deux critères principaux : des interactions sociales atypiques et des comportements et intérêts restreints et/ou stéréotypés. Mais au-delà de ces critères, les symptômes et impact sur la vie des personnes concernés peuvent fortement variés : déficience intellectuelle, hypersensibilité sensorielle ou à l’inverse hyposensibilité, émotivité face aux changements de l’environnement, troubles du sommeil, épilepsie, hyperactivité... Cette hétérogénéité rend complexe l’étude de l’autisme et de son origine.
Les scientifiques s’accordent toutefois aujourd’hui sur une forte composante génétique. Et c’est à l’Institut Pasteur que les premières mutations impliquées dans l’autisme ont été identifiées en 2003, par l’unité Génétique humaine et fonctions cognitives de Thomas Bourgeron, en collaboration avec des psychiatres français (Marion Leboyer) et suédois (Christopher Gillberg). Depuis, cette même unité continue d’étudier la part génétique de l’autisme. Grâce à ces chercheurs et à de nombreuses autres équipes dans le monde, plusieurs mutations génétiques ont été identifiées. Cependant, ces mutations ne sont pas toujours héréditaires : elles sont apparues après la naissance, ou de novo, dans 10 à 20% des cas.
Le groupe Neuroanatomie appliquée et théorique, dirigé par Roberto Toro à l’Institut Pasteur, s’intéresse au développement et à l’évolution de l’anatomie cérébrale. L’équipe utilise des méthodes de modélisation mathématique, d’imagerie par résonance magnétique et de génomique. « Nous développons une grande variété de méthodes pour comprendre la diversité naturelle du cerveau humain, ainsi que pour rechercher les différences associées aux pathologies neurodéveloppementales », explique Roberto Toro. Le groupe s’intéresse particulièrement à l'autisme.

Nos recherches montrent qu’il est très important de tester chez les animaux les biais émotionnels, surtout si on veut tester des médicaments et molécules qui sont censées inverser ces biais.
Quel est le modèle animal actuellement utilisé pour étudier la dépression ?
Chantal Henry : On parle de souris « depression-like », elles ont des symptômes et des paramètres biologiques communs avec la dépression humaine. La souris est moins active, elle fait moins d’effort en quête de nourriture, prend moins soin d’elle-même. Par exemple, si on l’ébouriffe avec de l’eau sucrée, la souris ne va pas se toiletter, alors qu’elle le fait en temps normal.
Pierre-Marie Lledo : On a aussi une perte de plaisir : si la souris a accès à de l’eau douce et à de l’eau sucrée, elle ne va pas montrer de préférence pour l’eau sucrée. Bref, en réduisant la dépression à des anomalies biologiques (facteurs sanguins et dysfonctionnement de circuits nerveux communs entre les rongeurs et les humains), il est possible de chercher à comprendre l’origine de la maladie en étudiant les rongeurs.
Comment la souris acquiert-elle ces symptômes ?
Pierre-Marie Lledo : Les souris deviennent « depression-like » lorsqu’elles sont face à un univers imprédictible, remplis de changements dans lesquels l’animal reste un spectateur et non acteur : par exemple, si la condition de vie de l’animal change chaque jour avec des menaces multiples (raréfaction de l’accès à l’eau, à la nourriture, isolement social, changement du cycle de lumière, etc.). Comme chez l’humain, face à l’adversité chronique, un animal va produire des hormones qui poussent l’organisme à s’adapter, comme un taux de cortisol élevé, ou de glucorticoïdes chez la souris.
Pourquoi est-ce difficile d’étudier la dépression chez la souris ? Et comment contourner ces difficultés ?
Chantal Henry : C’est ce que nous avons voulu vérifier. Dans les troubles de l’humeur, que ce soit les troubles dépressifs ou l’exaltation maniaque, il y a un biais perceptif. Dans la dépression, ce qui est plaisant devient déplaisant et est déplaisant le devient encore plus : c’est le biais émotionnel négatif.
Chez les souris ayant un phénotype* dépressif, on étudie souvent l’aspect moteur, mais rarement ce biais émotionnel.
Pierre-Marie Lledo : Le domaine de l’investigation en sciences comportementale à travers des modèles animaux s’est longtemps heurté à une vision simpliste selon laquelle la souris n’aurait pas d’états mentaux, pas d’intention et pas d’affect. Nous avons souhaité intégrer l’impact de l’affect dans nos recherches.
Chantal Henry : Pour vérifier qu’on le retrouvait chez le modèle animal, nous avons fait sentir des odeurs aux souris, positives, neutres ou négatives, sans qu’il y ait le moindre apprentissage. Par rapport aux autres, les souris qui ont un phénotype dépressif ont passé moins de temps sur les odeurs positives, agréables, et encore moins sur l’odeur négative. On a donc bien un biais négatif de perception.
*Phénotype : Ensemble des caractères apparents d’un individu, correspondant à une réalisation du génotype.
Pourquoi ces souris constituent un bon modèle pour étudier la dépression ?
Chantal Henry : En tenant compte des biais émotionnels, nous avons réussi à mettre en évidence qu’une circuiterie était modifiée au niveau de certains neurones qui sont dans une sous-partie de l’amygdale (l’endroit du cerveau ou est localisé le système de gestion et génération des émotions). On a une modification de l’activité des neurones qui code d’habitude pour le plaisant ou le déplaisant, les neurones qui codent pour le déplaisant sont plus actifs.
Cela confirme donc l’intérêt de ces souris comme modèle animal de la dépression, pour étudier cette maladie. A l’inverse, sur le modèle de souris utilisé pour son phénotype maniaque, on n’a pas retrouvé de biais émotionnel négatif, ce qui nous fait penser que ce n’est pas modèle adapté à l’étude de ce trouble.
Nos recherches montrent qu’il est très important de tester chez les animaux les biais émotionnels, surtout si on veut tester des médicaments et molécules qui sont censées inverser ces biais.
Comment vieillit le cerveau ?
Au fur et à mesure que nous vieillissons, notre cerveau vieillit également. Avec l’âge, certaines tâches comme la mémorisation ou l’apprentissage de nouvelles compétences peuvent devenir plus difficiles. Cela est dû à de nombreux phénomènes tels que le rétrécissement de certaines zones du cerveau et une diminution du nombre de connexions entre les neurones. De plus, des maladies comme Alzheimer ou Parkinson entraînent la dégénérescence de certains neurones du fait de l’accumulation de protéines mal repliées. Mener un mode de vie sain et rester actif physiquement, socialement et intellectuellement permet de diminuer les risques liés au vieillissement, mais pas de les supprimer totalement. Comprendre le processus de vieillissement et des différents troubles qui y sont associé afin de mieux les soigner fait partie des missions de l’Institut Pasteur.
Comprendre la mémoire
Pour soigner la mémoire, il faut comprendre celle-ci. Or, de nombreux aspects restent encore mystérieux. Des chercheurs de l’Institut Pasteur ont voulu comprendre comment les nouveaux souvenirs se formaint.
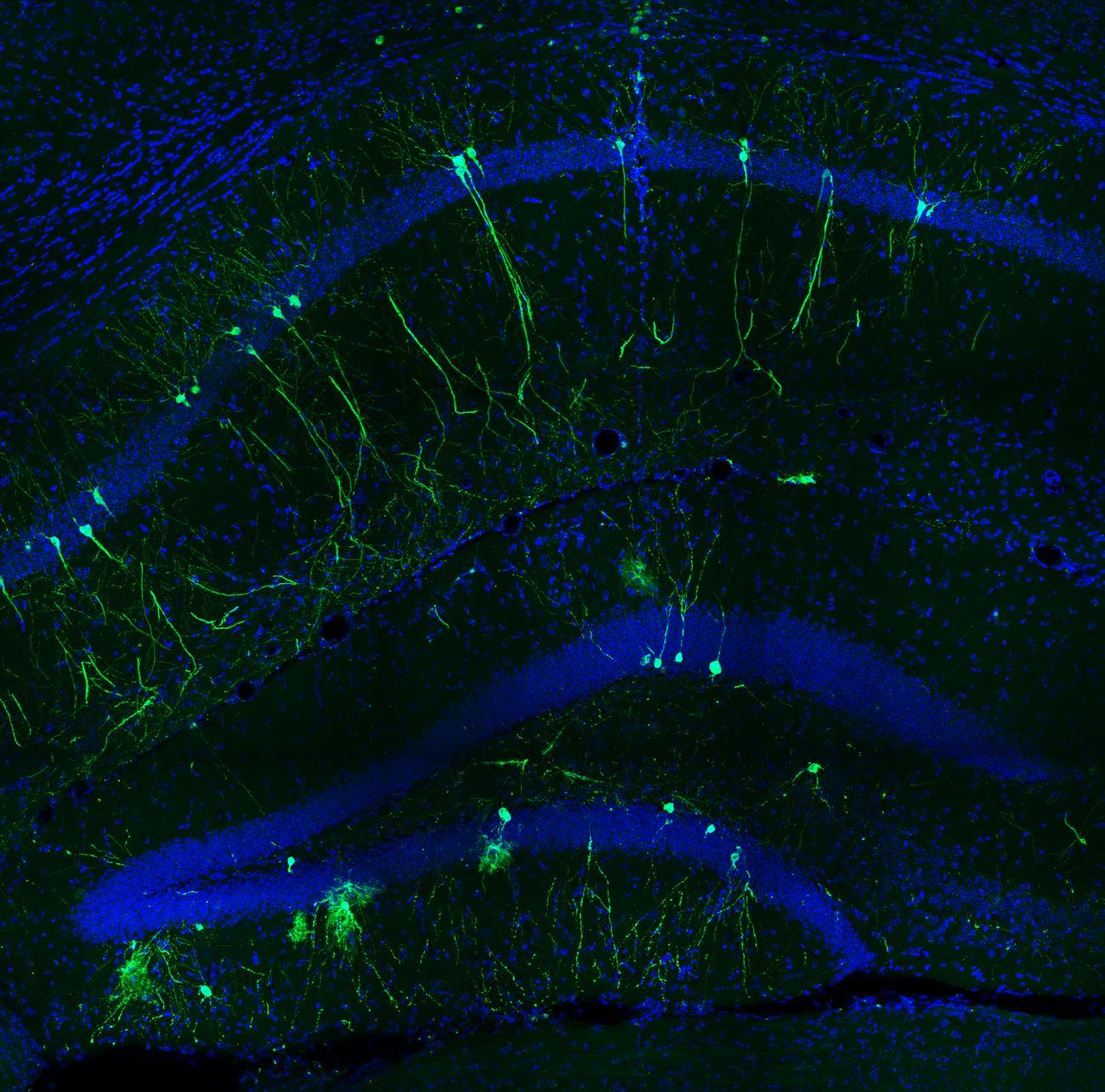
« Si vous visitez la tour Eiffel, par exemple, vous formez un premier souvenir. Puis si vous la visitez à nouveau, plusieurs choses doivent se passer : vous devez vous rappeler votre première visite, et en même temps former un nouveau souvenir distinct. La manière dont le cerveau réussi cela, c’était un mystère » explique Christophe Schmidt-Hieber, responsable du Groupe Circuits neuronaux de la navigation et de la mémoire spatiale à l’Institut Pasteur.
En 2020, les chercheurs avaient observé sur la souris l’implication de la région d’entrée de l’hippocampe, partie du cerveau particulièrement importante dans la formation des souvenirs épisodiques, c’est-à-dire d’un événement en particulier (lire Un air de déjà-vu ? Comment se forment les souvenirs distincts...). Cette région d’entrée décelait les moindre changements d’environnement, que celui-ci soit inconnu ou familier. Cette étude a permis de démontrer le rôle de l’hippocampe dans la formation des souvenirs distincts. Plus récemment, des scientifiques, dont Christophe Schmidt-Hieber, ont identifié le signal spécifique émis dans l’hippocampe (pré-publication) et responsable de l’identification d’un souvenir comme nouveau.
Déchiffrer les pathologies liées au vieillissement
Parmi les troubles liés à l’âge, les maladies d’Alzheimer et de Parkison sont parmi les plus connues. Ces deux maladies neurodégénératives ont de nombreux points communs. Elles sont toutes deux caractérisées par une dégénérescence de neurones : les neurones à dopamine de la substance noire du cerveau pour Parkinson, et ceux de diverses régions dont l’hippocampe, responsable de la mémoire à long terme pour la maladie d’Alzheimer. Un autre point commun est le rôle de protéines mal repliées dans la propagation de la maladie : les protéines tau pour la maladie d’Alzheimer et α-syn pour Parkinson. Ce mauvais repliement va se propager, et les protéines vont former des agrégats.
« Déchiffrer comment ces protéines se propagent et forment ces agrégats est primordial pour comprendre, et donc soigner, ces maladies » précise Chiara Zurzolo. L’unité Trafic membranaire et pathogenèse de l’Institut Pasteur, dirigée par cette dernière, a récemment mis en lumière deux mécanismes. Tout d’abord, les chercheurs ont élucidé la manière dont les protéines tau et α-syn se propage entre cellules neuronales. L’équipe a également mis en lumière l’implication des lysosomes dans la propagation des protéines α-syn dans la maladie de Parkinson et a montré que les protéines tau parvenaient à échapper à la dégradation dans la maladie d’Alzheimer. Ces découvertes pourront donner des pistes pour des nouvelles cibles thérapeutiques.
Dans la maladie d’Alzheimer, en plus de la protéine tau, les agrégats sont également constitués d’autres protéines appelées β-amyloïdes. L’Unité Neurobiologie intégrative des systèmes cholinergiques a développé un modèle qui exprime des protéines β-amyloïdes humaines, afin de mieux pouvoir étudier la maladie d’Alzheimer. Ils utilisent aussi des neurones humains à partir de cellules souches induites (iPSC) et les greffent dans un modèle in vivo.
Etudier l’interaction entre immunité et cerveau
Il existe de nombreuses preuves d’interactions entre le système immunitaire et le cerveau. Lorsqu’on est malade, le cerveau réagit à l’infection et on se « sent » malade. A l’inverse, il arrive d’avoir des réponses immunitaires anormales suite à des lésions cérébrales. « Chez les souris, on a remarqué qu’une absence de cellules T, un type de globule blanc, entraîne des facultés cognitives affaiblies. De même, les souris qui n’ont pas d’interferon gamma, un facteur antiviral primordial, deviennent anti-sociales » explique Aleksandra Deczkowska, responsable du laboratoire Interactions cerveau-immunité à l’Institut Pasteur.
Mais le fonctionnement de ces interactions n’est pas encore bien connu. Aleksandra Deczkowska étudie en particulier les cellules microgliales, et le rôle de l’immunité dans le vieillissement du cerveau. Les cellules microgliales semblent notamment avoir une implication dans la maladie d’Alzheimer : celles qui se trouvent autour des plaques amyloïdes expriment des gènes très spécifiques, ce qui suggère que ces cellules peuvent servir de rempart contre la maladie. « Notre laboratoire cherche désormais à comprendre les facteurs qui jouent dans la création de ces cellules, et s’il serait possible de les renforcer pour prévenir la maladie d’Alzheimer », conclut Aleksandra Deczkowska.
Vers un « élixir de jouvence » ?
C’est l’objet des recherches de Lida Katsimpardi. Lorsque la chercheuse était à Harvard, elle a découvert que le sang de jeunes souris, lorsqu’il était transféré à des souris plus âgées, permettait de limiter les effets du vieillissement en agissant sur la production de neurones et la vascularisation du cerveau. Elle a alors identifié un composé qui participait à cet effet, nommée GDF11. Désormais chercheuse Inserm au sein de l’unité Perception et mémoire à l’Institut Pasteur et à l’Institut Necker Enfants Malades, elle a réussi, avec ses collègues, à comprendre le rôle de cette protéine, qui est similaire à celui de la restriction calorique.
Après une infection par le virus SARS-CoV-2, certains patients « Covid » peuvent garder des symptômes plus ou moins grave, et ce pendant des mois. C’est ce qu’on appelle le Covid long. L’Institut Pasteur s’équipe pour mieux comprendre l’origine de cette persistance. Les chercheurs de L’unité Trafic membranaire et pathogenèse de l’Institut Pasteur, dirigée par Chiara Zurzolo, ont découvert que le SARS-Cov-2 n’est pas capable d’infecter directement les cellules neuronales, mais doit passer par des cellules permissives au virus comme les cellules épithéliales. Cette découverte conjugue à la fois l’étude de cultures in vitro, montrant que des neurones sains sont infectés s’ils sont mis en contact avec des cellules infectées, ainsi que l’utilisation d’outils de microscopie de pointe, comme le microscope Titan KriosTM de la plateforme Nanoimagerie de l’Institut Pasteur qui permet d’obtenir une résolution sans précédent d’échantillons biologiques et de nanomolécules, plus proches des conditions biologiques réelles.
Cette découverte va également dans le sens de la proposition d’autres chercheurs de l’Institut Pasteur que le virus atteindrait le cerveau en passant par les cellules de l’épithélium olfactive. Afin d’élucider ce mécanisme, les chercheurs de l’Institut Pasteur travaillent pour réaliser une installation permettant de la microscopie par excitation à deux photons. Cette technologie permet d’obtenir des images de tissus jusqu’à un millimètre de profondeur. « Ce microscope nous permettra d’étudier l’activité du cerveau de souris lorsqu’elles sont infectées par le SARS-Cov-2, ou par d’autres virus. Nous aimerions voir comment une infection active change l’activité des neurones dans le cerveau, mais aussi des cellules non-neuronales, par exemple les cellules microgliales. Ensuite, nous pourrons observer si l’activité cérébrale est toujours activée après l’infection », explique Uwe Maskos, responsable du laboratoire Neurobiologie intégrative des systèmes cholinergiques. Pour cela, le microscope sera installé dans un laboratoire P3. Afin de comprendre comment le SARS-CoV-2 pénètre le cerveau, et combien de temps il y reste, les chercheurs comptent utiliser une version fluorescente du virus. Ils ont déjà pu mettre en évidence que des neurones humains cultivés sont susceptibles d'être infectés par le virus en fonction du niveau d'expression de la protéine ACE2, site d'entrée dans la cellule.
De nouvelles cibles thérapeutiques
Comprendre le fonctionnement du cerveau, et son interaction avec différentes parties du corps, permet non seulement de mieux identifier les maladies mais également de mieux les soigner. Derrière chaque nouveau mécanisme découvert, peut se cacher le médicament de demain.
Des récepteurs nicotiniques à la découverte de nouveaux médicaments
Les récepteurs nicotiniques sont des molécules qui jouent des rôles extrêmement importants au sein du système nerveux : transmission neuromusculaire, implication dans la douleur, l’attention, la mémoire… Mais ces récepteurs sont également impliqués dans des addictions, notamment à la cigarette et à la cocaïne. Mieux comprendre leurs structures et fonctionnement peut donc permettre de trouver des médicaments pour faire face à ces addictions.
« Les récepteurs nicotiniques sont composés de cinq sous-unités. Certains de ces récepteurs sont composés de sous-unités différentes et intègrent une sous-unité nommée α5, et d’autres de cinq fois la même sous-unité, nommée α7 », détaille Pierre-Jean Corringer, cheurcheur au sein de l’UMR Gène, synapses et cognition à l’Institut Pasteur. Ces deux sous-types de récepteurs font justement l’objet de recherches de son équipe. « α5 n’a pas été étudié pendant longtemps, car elle n’est pas essentielle au fonctionnement du récepteur. Mais dans les années 2000, des études d’analyse du génome ont montré qu’une mutation particulière de α5 entraînait une susceptibilité à l’addiction au tabac et au cancer du poumon bien plus élevée que la moyenne ».
En 2018, des chercheurs de l’Institut Pasteur, en collaboration avec le CNRS, Sorbonne université et l’Inserm, ont montré chez le rat que cette mutation est également impliqué dans la rechute après un sevrage tabagique. La mutation a également un impact sur l’addiction à la cocaïne.
Tête à Tête avec Uwe Maskos : pourquoi est-il si difficile d’arrêter de fumer ?
Des molécules médicamenteuses ciblant cette sous-unité pourraient donc avoir un impact sur ces addictions. Le défi pour l’UMR Gène, synapses et cognition est désormais de trouver des molécules qui ciblent α5 spécifiquement, sans impacter le reste du récepteur nicotinique. « Ces molécules pourraient avoir des nombreuses applications, car la mutation sur α5 produit beaucoup de désordre : dépendance à la nicotine et cocaïne mais aussi la dépendance à l’éthanol et un effet plutôt général sur le système de récompense », conclut Pierre-Jean Corringer.
Trouver des composés qui ciblent α7, pourrait aussi avoir un impact très important : cette sous-unité joue notamment un rôle majeur dans la cognition!
Microbiote et dépression : l’espoir de nouveaux traitements ?
Les mécanismes biologiques de la dépression sont encore mal connus, ce qui complique la mise en place d’un traitement adapté. Mais la découverte de l’implication du microbiote pourrait mener à de nouveaux traitements.
Des chercheurs de l’Institut Pasteur ont découvert que, lorsqu’on transfère le microbiote des souris utilisées comme modèle de dépression à une autre souris (voir plus haut l'entretien avec Pierre-Marie Lledo et Chantal Henry), cette dernière montre également des symptômes de dépression. « Nous avons constaté que l’état dépressif entraîne une modification du microbiote intestinal et de ses fonctions. Il n’est pas encore clair comment cet état dépressif agit sur le microbiote, mais nous savons que le système immunitaire, qui contrôle ce microbiote, est altéré par la dépression », déclare Gérard Eberl, responsable de l’unité Microenvironnement et immunité. Dans le microbiote des souris qui présentent des symptômes de dépression manquent certaines bactéries, dont des lactobacilles.
Les chercheurs ont ensuite observé que la modification du microbiote intestinal entrainent un manque de certains composés dans le sang, dont le tryptophane, les diacides glycériques, l’acide arachidoniques. Or, le tryptophane est la base de la sérotonine, cette hormone qui manque dans la dépression. Le diacide glycérique, lui, est le composant de base de médiateurs très important dans le système immunitaire et le cerveau, notamment des endocannabinoïdes qui jouent un rôle crucial dans la régulation de l’humeur. Si elle est confirmée chez l’humain, cette découverte pourrait améliorer la prise en charge de la dépression. « La dépression a des causes diverses, mais notre découverte pourrait identifier les patients qui souffrent d’un manque de tryptophane ou d’acide arachidonique dans leur sang. Dans ce le cas, on pourrait complémenter ces manques afin de diminuer le risque de de dépression. »





