Le virus de la rage tue plus de 50 000 personnes chaque année. Les vaccins antirabiques actuels sont efficaces, mais ils ne protègent pas à vie et nécessitent des doses de rappel. Des scientifiques de l’Institut Pasteur, en collaboration avec des chercheurs de La Jolla Institute for immunology aux Etats-Unis, ont obtenu de nouvelles images haute résolution du virus de la rage, révélant des cibles vaccinales potentielles. Ces résultats sont publiés dans la revue Science Advances, le 17 juin 2022.
Le virus de la rage tue chaque année plus de 50 000 personnes, dont de nombreux enfants. Certaines victimes, en particulier les plus jeunes, n’apprennent leur exposition au virus qu’une fois qu’il est trop tard. Pour d’autres, la prophylaxie post exposition est soit indisponible soit non envisageable, son coût moyen étant trop élevé pour les populations exposées dans les pays en développement.
Les vaccins contre la rage, présentent un inconvénient majeur : ils ne protègent pas à vie. Les animaux doivent recevoir une dose de rappel tous les 1 à 3 ans. Actuellement, les vaccins contre la rage destinés aux populations humaines et aux animaux domestiques sont produits à partir du virus inactivé. Or, le processus d’inactivation peut entraîner une déformation des molécules que les vaccins présentent au système immunitaire.
Les chercheurs de l’unité Lyssavirus, épidémiologie et neuropathologie à l’Institut Pasteur en collaboration avec une équipe de La Jolla Institute for immunology, ont découvert comment perfectionner la conception des vaccins. Dans une nouvelle étude publiée dans la revue Science Advances, ces chercheurs partagent l’une des premières vues haute résolution de la glycoprotéine du virus de la rage dans sa forme « trimérique » vulnérable.
« Si nous améliorions la forme et la structure du vaccin, l’immunité durerait peut-être plus longtemps. » indique Dr Erica Ollmann Saphire, professeure et directrice générale de La Jolla Institute for immunology, et principale auteur de l’étude. « La glycoprotéine de la rage est la seule protéine que le virus de la rage exprime à sa surface, ce qui signifie qu’elle est la cible principale des anticorps neutralisants pendant l’infection », explique Heather Callaway, postdoctorante à La Jolla Institute for immunology et première auteure de l’étude.
« Le virus de la rage est le virus le plus mortel que nous connaissons. Il est ancré dans notre Histoire. Nous vivons avec son spectre depuis des centaines d’années », ajoute Dr Ollmann Saphire, « Pourtant, aucun chercheur n’a jamais observé l’organisation de sa molécule de surface. Or, pour mettre au point des vaccins et des traitements plus efficaces et pour comprendre le mode d’entrée de la rage et d’autres virus similaires dans les cellules, il est important de décrypter cette structure. »
« Ce décryptage est indispensable à la conception de meilleurs vaccins et au développement de traitements pour les patients infectés », ajoute Pr Hervé Bourhy, responsable de l’unité Lyssavirus, épidémiologie et neuropathologie à l’Institut Pasteur.
La glycoprotéine du virus de la rage : une protéine à plusieurs visages
Les scientifiques ne sauraient expliquer précisément pourquoi les vaccins antirabiques n’offrent pas de protection à long terme, mais ils savent que les changements de forme des protéines de la rage sont problématiques.
À l’image d’un couteau suisse, la glycoprotéine de la rage présente des séquences qui se déplient et se replient au besoin. Elle peut passer d’une forme pré-fusionnelle (avant la fusion avec une cellule hôte) à une forme post-fusionnelle, et inversement. Elle peut également se morceler, transitant d’une structure trimérique (trois copies assemblées) à une structure monomérique (une copie isolée).
Cette métamorphose confère à la rage une sorte de cape d’invisibilité. Les anticorps humains sont voués à ne reconnaître qu’un seul site sur une protéine. Ils sont incapables de repérer la transformation d’une protéine pour cacher ou déplacer des sites.
Cette nouvelle étude fournit aux chercheurs une image critique de la forme de la glycoprotéine à cibler pour garantir l’efficacité et la durée de la protection par les anticorps.
La glycoprotéine enfin capturée
Pendant trois ans, les scientifiques ont travaillé à la stabilisation et au gel de la glycoprotéine de la rage sous sa forme trimérique. La glycoprotéine prend cette forme « pré-fusionnelle » avant d’infecter les cellules humaines.
En associant la glycoprotéine à un anticorps humain, les équipes ont pu identifier un site au niveau duquel la structure virale est vulnérable aux attaques des anticorps. Les chercheurs ont ensuite obtenu une image 3D de la glycoprotéine grâce à un équipement de cryo-microscopie électronique de pointe de La Jolla Institute for immunology. « Cette image nous aide à comprendre le mode d’action des anticorps qui neutralisent le virus », explique Hervé Bourhy de l’Institut Pasteur.
La nouvelle structure 3D met en évidence plusieurs caractéristiques clés jusque-là inconnues des chercheurs, notamment deux composantes majeures de la structure du virus – les peptides de fusion – telles qu’elles apparaissent dans la réalité. Ces deux séquences lient la partie inférieure de la glycoprotéine à la membrane virale, mais font saillie dans la cellule cible pendant l’infection. L’obtention d’une image stable de ces séquences se révèle très difficile.
Les scientifiques ont solutionné le problème en capturant la glycoprotéine de la rage dans des molécules de détergent. Ils ont ainsi pu observer la fixation des séquences de fusion avant leur déploiement au cours de l’infection.
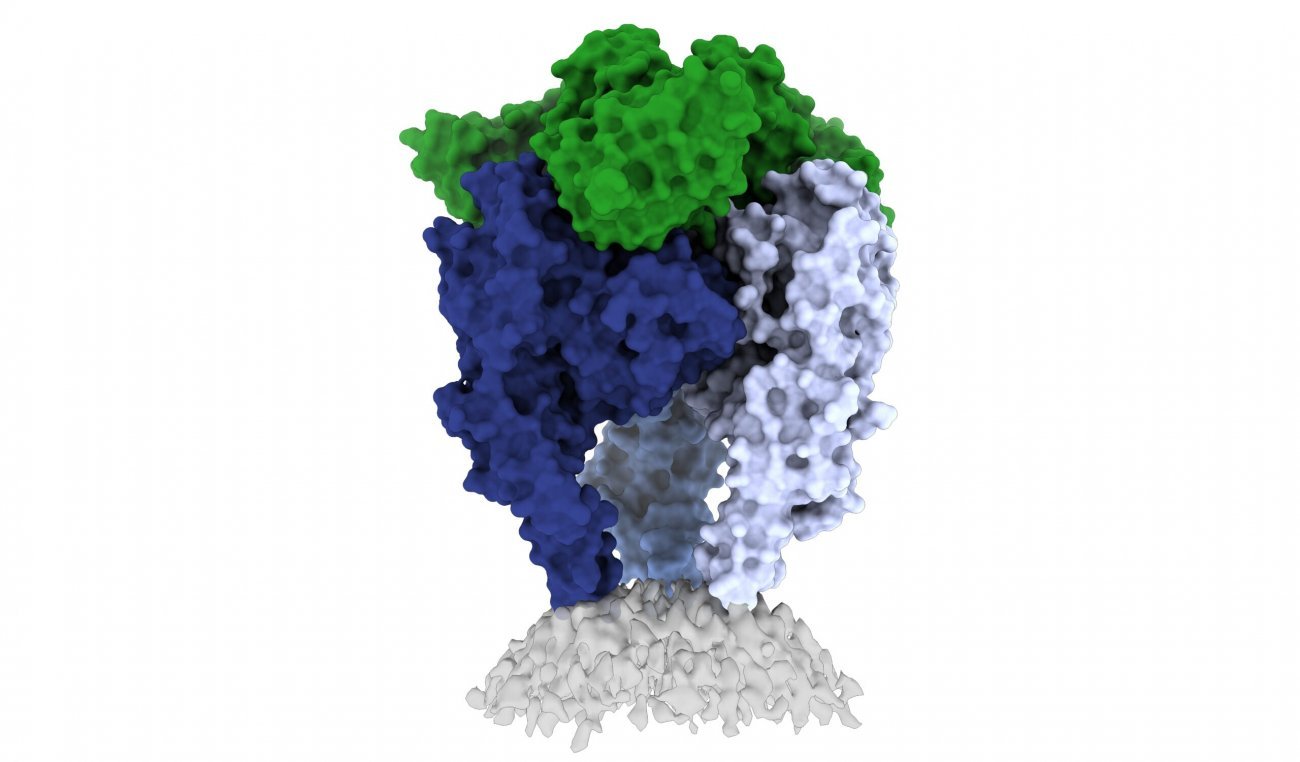 |
|
Des chercheurs de La Jolla Institute for Immunology (LJI) et de l’Institut Pasteur ont mis en évidence la structure de la glycoprotéine du virus de la rage, illustrée ici (image avec l’aimable autorisation du Dr Heather Callaway, du LJI). |
Cette vision claire de la structure virale permet désormais aux scientifiques de concevoir des vaccins qui indiquent à l’organisme comment fabriquer des anticorps ciblant le virus.
Le système immunitaire ne serait plus exposé à au moins quatre formes de protéines différentes, mais à une seule, et la bonne. Le vaccin pourrait s’en trouver amélioré.
Une prévention contre toute une famille de virus
Les personnes en contact régulier avec des animaux, comme les vétérinaires et les soigneurs animaliers, ainsi que les milliards d’individus qui croisent accidentellement un animal enragé pourraient bénéficier d’une immunité plus forte et plus large. La rage est endémique sur tous les continents, à l’exception de l’Antarctique, et infecte de nombreuses espèces animales, dont les chiens, les ratons laveurs, les chauves-souris et les mouffettes.
Ces nouveaux travaux pourraient également ouvrir la voie au développement d’un vaccin protégeant contre l’ensemble des virus du genre Lyssavirus, comprenant la rage et d’autres virus similaires transmissibles à l’être humain par d’autres mammifères que le chien.
Les chercheurs du Center for Infectious Disease and Vaccine Research à La Jolla Institute for Immunology et les chercheurs de l’unité Lyssavirus, épidémiologie et neuropathologie à l’Institut Pasteur poursuivent leurs travaux de recherche et visent maintenant à obtenir davantage d’images du virus de la rage et de virus apparentés avec des anticorps neutralisants. L’absence, jusqu’à présent, de ces structures du virus rabique dans cet état conformationnel compliquait la conception d’un vaccin à large spectre. Les chercheurs s’emploient à élucider plusieurs de ces structures, ce qui pourrait révéler des cibles d’anticorps communes aux virus du genre Lyssavirus.
Source
Structure of the rabies virus glycoprotein trimer bound to a prefusion-specific neutralizing antibody, Science Advances, 17th June 2022
Heather M. Callaway1, Dawid Zyla1, Florence Larrous2, Guilherme Dias de Melo2,
Kathryn M. Hastie1, Ruben Diaz Avalos1, Alyssa Agarwal1, Davide Corti3,
Hervé Bourhy2, Erica Ollmann Saphire1
1 Center for Infectious Disease and Vaccine Research, La Jolla Institute for Immunology, La Jolla, CA, USA.
2 Institut Pasteur, Université Paris Cité, Unit of Lyssavirus Epidemiology and Neuropathology, World Health Organization Collaborating Centre for Reference and Research on Rabies, Paris, France.
3 Humabs Biomed SA, a subsidiary of Vir Biotechnology, Bellinzona, Switzerland.
4 Department of Medicine,
University of California San Diego, La Jolla, CA, USA.
*Corresponding author.