Des chercheurs de l’Institut Pasteur, de l’Inserm, du Collège de France et de l’université Pierre et Marie Curie en étroite collaboration avec des chercheurs de l’Université d’Auvergne viennent de découvrir la fonction de la pejvakine, une molécule essentielle au système auditif. Son absence serait en effet responsable des surdités liées au bruit, une des causes les plus fréquentes des pertes d’audition. La découverte des scientifiques, qui vient d'être publiée le 5 novembre, dans la revue Cell, offre de nouvelles perspectives dans la prise en charge des patients.
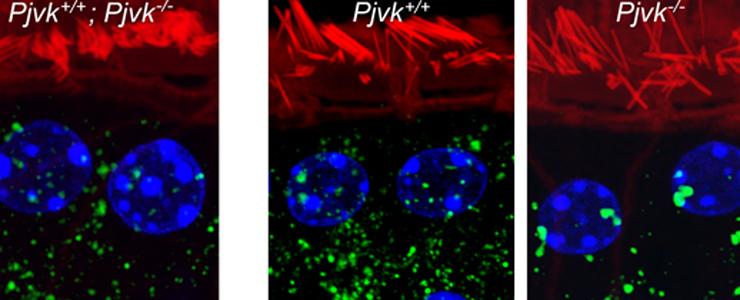
Avant exposition sonore Après exposition sonore
L’exposition sonore provoque une prolifération des peroxysomes (en vert) dans les cellules sensorielles auditives de souris pourvues de pejvakine (Pjvk+/+, au milieu), et cause leur dégénérescence chez la souris dépourvue de pejvakine (Pjvk-/-, à droite). © Institut Pasteur
En 2006, l’équipe de Christine Petit (unité de Génétique et Physiologie de l'Audition à l’Institut Pasteur) et tout particulièrement Sedigheh Delmaghani, en collaboration avec l’équipe de Paul Avan (Laboratoire de Biophysique Sensorielle, Université d’Auvergne), avait identifié un nouveau gène responsable d’une surdité neurosensorielle précoce. La protéine codée par ce gène avait alors été baptisée « pejvakine » ("écho" en persan). Les tests audiométriques pratiqués chez des individus porteurs de mutations dans ce gène ont depuis mis en lumière une diversité inhabituelle des atteintes auditives tant dans leur sévérité que leurs caractéristiques propres. C’est l’origine de cette hétérogénéité que les chercheurs de l’Institut Pasteur, de l’Inserm, du Collège de France, de l’université Pierre et Marie Curie et de l’Université d’Auvergne se sont attachés à élucider dans cette étude.
Les scientifiques et principalement Sedigheh Delmaghani, ont ainsi étudié des souriceaux dont le gène de la pejvakine est inactivé. Leurs observations ont révélé des atteintes auditives étonnamment variables d’un souriceau à l’autre, s’échelonnant d’une surdité légère à profonde. Les petits vocalisent intensément pendant leurs trois premières semaines de vie, tout particulièrement au moment de la tétée. Plus ils sont nombreux dans la cage, plus l’environnement acoustique est donc bruyant. Les chercheurs ont pu observer que le seuil auditif des souriceaux – niveau sonore à partir duquel ils perçoivent les sons – augmentait avec leur nombre dans la cage. Par stimulation acoustique directe et contrôlée, ils ont pu prouver que c’est effectivement l’environnement acoustique des souriceaux qui traumatise leur système auditif lorsqu’il était dépourvu de pejvakine.
Les chercheurs se sont alors penchés sur les causes physiologiques de ce phénomène. Ils ont alors observé qu’en l'absence de pejvakine, les cellules sensorielles auditives des souriceaux s'altèrent dès qu’ils sont exposés à des sons, même anodins : l'équivalent, chez l’homme, d'une minute en discothèque. Il faut alors deux semaines maintenues dans le silence pour que ces cellules récupèrent leur fonctionnalité. Si l'exposition se prolonge ou se répète, ces cellules finissent par mourir. Plus précisément, les chercheurs ont identifié au sein de la cellule l’élément sensible au bruit : il s’agit du peroxysome, un petit organite impliqué dans les fonctions de détoxification. « En d’autres termes, nous avons découvert qu’une atteinte génétique pouvait être à l’origine de pertes de l’audition déclenchées par des sons même faibles », explique Christine Petit.
Chez les personnes dont la pejvakine est altérée, une hypervulnérabilité aux sons de ces mêmes cellules, est observée. Ainsi, lors d’un test audiologique standard pratiqué chez ces malentendants, les réponses des cellules sensorielles auditives et des neurones, initialement normales, s’altèrent progressivement au cours de l’examen sous l’effet de la stimulation sonore.
La prévalence de la surdité liée au bruit va grandissante. En raison de la surpopulation, les mégapoles sont de plus en plus bruyantes, en particulier dans les pays en développement. L’OMS prédit qu’en 2030, un milliard d’individus seront soumis au risque de perte auditive par surexposition au bruit. « Certains d'entre nous ont des défenses naturelles moins efficaces que d'autres contre les effets de la surexposition sonore, expliquent les Prs Avan et Petit. Cinq millions de Français finissent par être affectés de pertes auditives qui altèrent leur vie sociale. L'appareillage auditif est une solution, mais son principe est d'exposer le porteur d'appareils à des sons amplifiés, donc forts. Or, on ne sait pas encore quel pourcentage de la population ne possède pas de pejvakine, ou une forme moins efficace. Nos résultats indiquent que chez ces personnes, les prothèses auditives devraient être non seulement inefficaces mais sans doute délétères ».
Les chercheurs vont désormais explorer des pistes pour réparer l’action de la pejvakine, notamment par la thérapie génique qui a déjà fait ses preuves chez la souris en préservant l'audition de souris dépourvues de pejvakine, même lorsqu’elles sont surexposées au bruit.
Ces travaux ont reçu le soutien financier de la Louis-Jeantet Foundation, la Fondation Bettencourt Schueller, Humanis, AG2R La Mondiale, la Fondation BNP Paribas et la Fondation Agir pour l’Audition.
Source
Hypervulnerability to sound-exposure through impaired adaptive proliferation of peroxisomes, Cell, 5 novembre 2015.
Sedigheh Delmaghani (1,2,3), Jean Defourny (1,2,3), Asadollah Aghaie (2,3,4), Maryline Beurg (5), Didier Dulon (5), Nicolas Thelen (6), Isabelle Perfettini (1,2,3), Tibor Zelles (7,8), Mate Aller (7), Anaïs Meyer (1,2,3), Alice Emptoz,(1,2,3), Fabrice Giraudet (9,10,11), Michel Leibovici (1,2,3), Sylvie Dartevelle (12), Guillaume Soubigou (13), Marc Thiry (6), E. Sylvester Vizi (7), Saaid Safieddine (1,2,3), Jean-Pierre Hardelin (1,2,3), Paul Avan (9,10,11,15) and Christine Petit (1,2,3,4,14,15,*)
(1) Unité de Génétique et Physiologie de l’Audition, Institut Pasteur, 75015 Paris, France
(2) UMRS 1120, Institut National de la Santé et de la Recherche Médicale (INSERM), 75015 Paris, France
(3) Sorbonne Universités, UPMC Université Paris 06, Complexité du Vivant, 75005 Paris, France
(4) Syndrome de Usher et Autres Atteintes Rétino-Cochléaires, Institut de la Vision, 75012 Paris, France
(5) Equipe Neurophysiologie de la Synapse Auditive, Université de Bordeaux, Neurosciences Institute, CHU Pellegrin, 33076 Bordeaux, France
(6) Unit of Cell and Tissue Biology, GIGA-Neurosciences, University of Liege, CHU Sart-Tilman, B36, 4000 Liege, Belgium
(7) Institute of Experimental Medicine, Hungarian Academy of Sciences, H-1083 Budapest, Hungary
(8) Department of Pharmacology and Pharmacotherapy, Semmelweis University, H-1089 Budapest, Hungary
(9) Laboratoire de Biophysique Sensorielle, Université d’Auvergne, 63000 Clermont-Ferrand, France
(10) UMR 1107, Institut National de la Santé et de la Recherche Médicale (INSERM), 63000 Clermont-Ferrand, France
(11) Centre Jean Perrin, 63000 Clermont-Ferrand, France
(12) Plateforme d’Ingénierie des Anticorps, Institut Pasteur, 75015 Paris, France
(13) Plateforme Transcriptome et épigénome, Institut Pasteur, 75015 Paris, France
(14) Collège de France, 75005 Paris, France
(15) Coauteur senior
(*) Auteur correspondant





