Le virus de la fièvre de la Vallée du Rift, transmis par des moustiques, est responsable d’épidémies chez l’animal en Afrique et peut être mortel chez l’Homme. Des chercheurs de l’Institut Pasteur et du CNRS, en collaboration avec l’université de Goettingen, ont caractérisé le mécanisme d’insertion d’une protéine de l’enveloppe du virus dans la membrane cellulaire de l’hôte, et qui lui permet ainsi d’infecter la cellule. Ils ont montré que la protéine d’enveloppe virale présente une « poche » qui reconnait certains lipides de la membrane cellulaire. Cette poche est également présente chez d’autres virus transmis par d’autres moustiques, comme les virus Zika et chikungunya. La compréhension de ces interactions devrait permettre l’identification de nouvelles stratégies thérapeutiques ciblant des virus transmis par ces moustiques. Ces résultats sont publiés le 3 novembre 2017 dans la revue Science.
Le virus de la fièvre de la Vallée du Rift est un bunyavirus isolé pour la première fois chez des moutons en 1930 au Kenya. Il provoque des pathologies sévères et représente donc une menace pour les troupeaux. Sa propagation peut avoir des conséquences économiques dramatiques en Afrique. Le virus peut aussi se transmettre à l’Homme lors de contacts avec les animaux contaminés ou par piqûre de moustiques infectés, et peut ainsi conduire à des encéphalites sévères et des fièvres hémorragiques graves, voire mortelles. En 2000, le virus s’est propagé en dehors du continent africain, en Arabie Saoudite et au Yemen. Une émergence de ce virus en Asie et en Europe est également possible.
Pour que le virus de la fièvre de la Vallée du Rift se propage chez son hôte, il doit fusionner avec la membrane des cellules pour s’y multiplier et infecter d’autres cellules. Les chercheurs de l’unité de Virologie structurale (Institut Pasteur/CNRS), dirigée par Félix Rey, en collaboration avec l’université de Goettingen, ont caractérisé le mécanisme utilisé par le virus pour insérer une de ses protéines de surface dans la membrane des cellules de l’hôte, et ont déterminé la structure atomique de ce nouveau complexe protéine/lipide. Ils ont montré que cette protéine présente une « poche » qui reconnait spécifiquement les têtes hydrophiles de certains lipides constituant la membrane cellulaire. Cette poche de reconnaissance est présente non seulement chez le virus de la fièvre de la Vallée du Rift, mais aussi sur des protéines d’enveloppe d’autres familles virales qui sont aussi transmises par les arthropodes, tels le virus de la dengue, le virus Zika ou le virus chikungunya. Les chercheurs ont notamment constaté qu’un des résidus de la poche de reconnaissance est l’acide aminé 226 chez la protéine homologue du virus chikungunya, pour lequel la mutation A226V en 2006 avait permis la transmission par une nouvelle espèce de moustique très présent dans l’Ile de la Réunion ( Aedes albopictus, ou moustique « tigre »).
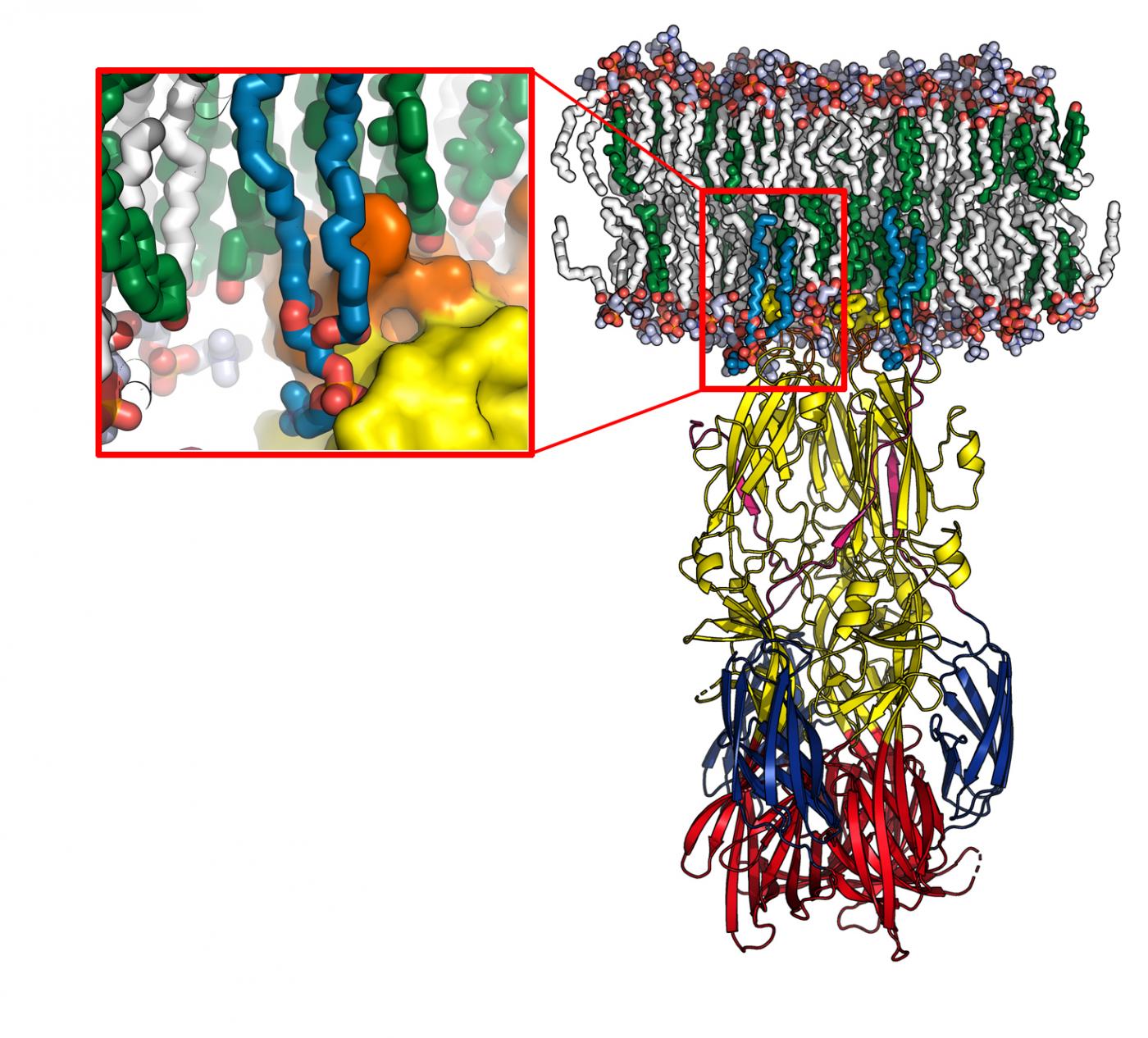
Modèle obtenu par dynamique moléculaire de la protéine de fusion interagissant avec une membrane cellulaire (en blanc et vert). L’agrandissement montre la « poche de reconnaissance » de la tête lipidique, avec la protéine représentée en surface © Pablo Guardado-Calvo, Institut Pasteur
« Cette étude apporte une illustration supplémentaire que l’étude comparative de virus pourtant très distants, comme les bunyavirus, les alphavirus et les flavivirus, peut avoir des répercussions fondamentales, et mettre en évidence leurs mécanismes d’action communs » commente Félix Rey, responsable de l’unité de Virologie structurale (Institut Pasteur/CNRS), où l’étude a été conduite.
La compréhension du mécanisme d’insertion de ces virus dans la membrane cellulaire laisse envisager le développement d’agents thérapeutiques ciblant cette poche impliquée dans la fusion des membranes virales et cellulaires, qui bloqueraient ainsi l’entrée des arbovirus pathogènes dans les cellules de leur hôte.
Source
* A glycerophospholipid-specific pocket in the RVFV class II fusion protein drives target membrane insertion, Science, 3 novembre 2017
P. Guardado-Calvo,1,2 K. Atkovska,3 S. A. Jeffers,1,2† N. Grau,1,2‡ M. Backovic,1,2 J. Pérez-Vargas,1,2§ S. M. de Boer,4 M. A. Tortorici,1,2 G. Pehau-Arnaudet,5 J. Lepault,6 P. England,5,7 P. J. Rottier,4 B. J. Bosch,4 J. S. Hub,3 F. A. Rey,1,2
(1) Institut Pasteur, Département de Virologie, Unité de Virologie Structurale, 75724 Paris Cedex 15, France.
(2) UMR 3569 Virologie, CNRS–Institut Pasteur, 25–28 Rue du Docteur Roux, 75015 Paris, France
(3) Institute for Microbiology and Genetics, University of Goettingen, Justus-von-Liebig weg 11, 37077 Göttingen, Germany
(4) Department of Infectious Diseases and 4Immunology, Virology Division, Faculty of Veterinary Medicine, Utrecht University, Utrecht, The Netherlands
(5) UMR 3528, CNRS, Institut Pasteur, 25-28 rue du Docteur Roux, 75015 Paris, France
(6) UMR9198, Institut de biologie intégrative de la cellule, CNRS, CEA, Université Paris Sud, France
(7) Institut Pasteur, Proteopole, Plateforme de Biophysique des Macromolécules et de leurs Interactions (PFBMI), 25-28 rue du Dr Roux, F-75724 Paris Cedex 15, France