Découverte d’un mécanisme cellulaire impliqué dans le développement anormal du placenta lors de certaines grossesses pathologiques.
Les grossesses pathologiques sont fréquentes et d’origines variées. On estime que des fausses couches ont lieu chez 10 à 20% des femmes enceintes lors des 3 premiers mois de grossesse. Les retards de croissance du fœtus peuvent aussi survenir lors d’infections maternelles par certains microbes, parasites ou virus (par exemple la toxoplasmose, les infections au virus de la rubéole, au cytomégalovirus, aux virus de l’Herpès ou Zika), ou au cours de maladies génétiques ou auto-immunes. Des équipes de l’Institut Pasteur, du CNRS, de l’Inserm, de l’hôpital Necker-Enfants malades AP-HP et de l’Université de Paris, ont identifié un nouveau mécanisme cellulaire qui altère la formation du placenta et pourrait ainsi provoquer des complications graves pendant la grossesse. Il est lié à la production d’interféron, une molécule qui est produite en réponse à certaines infections, notamment virales. Ces résultats sont publiés dans Science, le 11 juillet 2019.
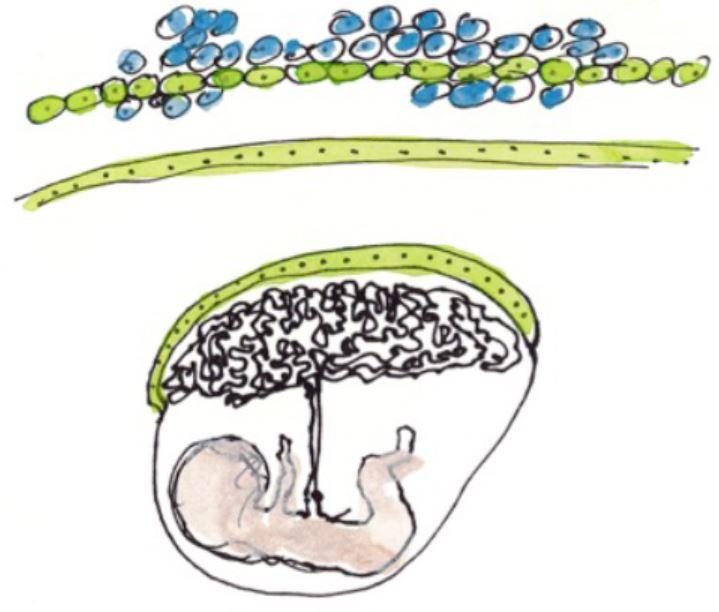
Représentation artistique de cellules et du placenta © Fabrice Hyber - Organoïde-Institut Pasteur
Le placenta constitue à la fois une surface d’échange et une barrière entre la mère et le fœtus, car il permet l’apport de nutriments nécessaires à la croissance du fœtus, la production d'hormones, ainsi qu'une protection du fœtus contre les microbes et le système immunitaire maternel. La couche externe du placenta s’appelle le « syncytiotrophoblaste ». Celui-ci est constitué de cellules qui fusionnent entre elles et forment des cellules géantes, assurant ainsi de façon optimale les fonctions de barrière et d’échanges du placenta. La fusion des cellules est assurée par des protéines appelées « syncytines ». Si le syncytiotrophoblaste ne se forme pas correctement, ceci peut entrainer une insuffisance placentaire et entraver le bon développement du fœtus. Par exemple, un syncytiotrophoblaste anormal peut être observé dans des pathologies telles que le retard de croissance intra-utérin, le lupus et chez les femmes portant un fœtus présentant une trisomie 21.
L’interféron est une substance fabriquée par les cellules immunitaires lors d’infections et permet de combattre les virus et d’autres microbes intracellulaires. Des taux élevés d’interféron sont observés dans des maladies auto-immunes ou inflammatoires telles que le lupus, ainsi qu’au cours de certaines infections. Dans cette étude, les chercheurs ont montré que l’interféron est responsable d’anomalie du placenta et qu’il agit en empêchant la formation du syncytiotrophoblaste. Plus précisément, l’interféron va induire la production d’une famille de protéines cellulaires, appelées « IFITM » (interferon-induced transmembrane proteins) qui bloquent l’activité de fusion des syncytines.
Les protéines IFITM ont une fonction bénéfique car elles empêchent les virus de fusionner avec la membrane cellulaire et donc d’entrer dans la cellule pour se multiplier. Les chercheurs montrent ici grâce à des modèles expérimentaux et des cellules humaines que cet effet bénéfique s’accompagne cependant de dommages si ces protéines sont produites de façon importante au niveau du placenta.
« L’identification du rôle d’IFITM permet de mieux comprendre les mécanismes du développement placentaire et sa perturbation au cours d’infections et d’autres pathologies » commente Olivier Schwartz, chef de l’unité Virus et immunité à l’Institut Pasteur, co-dernier auteur de l’étude. Les chercheurs souhaitent étudier si des pathologies placentaires de cause inconnue, telles que certains avortements spontanés précoces et situations de pré-éclampsies, impliquent aussi les protéines IFITM. A plus long terme, un blocage des effets d’IFITM pourrait constituer une nouvelle stratégie thérapeutique pour prévenir les anomalies placentaires liées à l’interféron.
Ces travaux ont été financés par, outre les institutions mentionnées ci-dessus, l’ANRS, Sidaction, l’Institut de recherche vaccinale (VRI), le Labex IBEID, et l’European Research Council (ERC).
Source
IFITM proteins inhibit placental syncytiotrophoblast formation and promote fetal demise, Science, 11 juillet 2019
Julian Buchrieser1,2*†, Séverine A. Degrelle3,4,5*, Thérèse Couderc6,7*, Quentin Nevers1,2*, Olivier Disson6,7, Caroline Manet8,9, Daniel A. Donahue1,2, Françoise Porrot1,2, Kenzo-Hugo Hillion10, Emeline Perthame10, Marlene V. Arroyo1,2,11, Sylvie Souquere12, Katinka Ruigrok2,13, Anne Dupressoir14,15, Thierry Heidmann14,15, Xavier Montagutelli8, Thierry Fournier3,4‡, Marc Lecuit6,7,16‡, Olivier Schwartz1,2,17†‡
1 Virus and Immunity Unit, Institut Pasteur, Paris, France.
2 CNRS-UMR3569, Paris, France.
3 INSERM, UMR-S1139, Faculté de Pharmacie de Paris, Paris, France
4 Université Paris Descartes, Sorbonne Paris Cité, Paris, France
5 Inovarion, Paris, France
6 Biology of Infection Unit, Institut Pasteur, Paris, France
7 Institut National de la Santé et de la Recherche Médicale U1117, Paris, France
8 Mouse Genetics Laboratory, Institut Pasteur, Paris, France
9 AgroParisTech, Paris, France
10 Bioinformatics and Biostatistics Hub – C3BI, Institut Pasteur, USR 3756 IP CNRS – Paris, France
11 Department of Biochemistry and Molecular Biophysics and Department of Microbiology and Immunology, Howard Hughes Medical Institute, Columbia University, New York, NY 10032, USA
12 Plateforme de Microscopie Electronique Cellulaire, UMS AMMICA, Gustave Roussy, Villejuif, France
13 Structural Virology Unit, Institut Pasteur, Paris, France
14 Unité Physiologie et Pathologie Moléculaires des Rétrovirus Endogènes et Infectieux, Hôpital Gustave Roussy, Villejuif, France
15 UMR 9196, Université Paris-Sud, Orsay, France
16 Université de Paris, Department of Infectious Diseases and Tropical Medicine, Necker-Enfants Malades University Hospital, APHP, Institut Imagine, Paris, France
17 Vaccine Research Institute, Créteil, France.
* These authors contributed equally to this work.
‡ These authors contributed equally to this work.
† Corresponding author