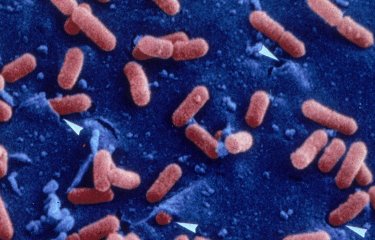
Une étude menée par des chercheurs de l'Institut Pasteur, associés à l'Inserm et à l'INRA, dévoile comment Listeria monocytogenes, la bactérie responsable de la listériose, module l'activité de tout son génome pour passer d'un état inoffensif à un état pathogène. Ces travaux, mis en ligne en édition avancée, seront publiés dans la revue Nature du 18 juin 2009.
Communiqué de presse
Paris, le 11 juin 2009
Des chercheurs de l’Institut Pasteur, au sein de l’unité des Interactions bactéries-cellules (unité Inserm 604, INRA USC2020), dirigée par Pascale Cossart, en collaboration avec d’autres groupes de l’Institut Pasteur (groupe Microorganismes et barrières de l’hôte, Inserm Avenir 604 ; unité postulante Génétique in silico, Génopole de l’Institut Pasteur) et une équipe suédoise, ont mis en évidence comment cette bactérie inoffensive de l’environnement devient un dangereux pathogène une fois hébergée par son hôte mammifère.
Grâce à de nouvelles puces à ADN, permettant d’analyser l’expression de tout le génome de la bactérie, -gènes et régions situées entre les gènes- les scientifiques ont cherché à comparer l’activité de l’ensemble des gènes de la bactérie dans son état inoffensif et dans son état pathogène. Ils ont pour cela analysé la totalité des produits des gènes de la bactérie (les ARNs) et étudié leurs régulations lorsque la bactérie croît dans l’environnement ou dans l’hôte infecté (dans l’intestin ou dans le sang). Obtenues à partir de l’ADN, support de l’information génétique, ces molécules d’ARN résultent de l’activité de la totalité des gènes. L’ensemble de tous les ARNs d’un génome à un temps donné s’appelle un transcriptome.
Les résultats de cette analyse dite « transcriptomique » ont d’abord montré que lorsque la bactérie atteint l’intérieur de l’intestin, puis la circulation sanguine, elle module massivement l’activité de son génome et active successivement différents groupes de gènes de virulence. De plus, 50 petits ARNs ont été identifiés. Certains sont absents de l’espèce non-pathogène Listeria innocua : au moins deux de ces petits ARNs contribuent à la virulence de Listeria monocytogenes. Les chercheurs ont par ailleurs découvert une série de nouveaux types d’ARNs régulateurs qui existent sans doute aussi dans d’autres bactéries.
Ces travaux ouvrent la voie à la compréhension complète des mécanismes d’adaptation de Listeria lorsque la bactérie passe de l’environnement à l’hôte infecté. Ils ouvrent surtout aussi des perspectives nouvelles dans le domaine très compétitif que représente la régulation par les ARNs, dans toutes les espèces du monde vivant.
--
Illustration - Copyright Institut Pasteur
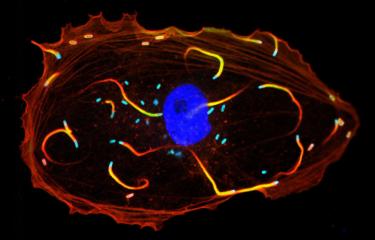
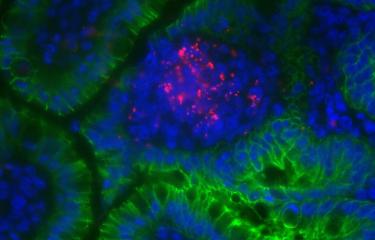
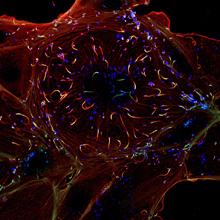
Observation en immunofluorescence d’une cellule (rouge et vert) infectée par Listeria monocytogenes (bleu). Copyright Institut Pasteur.
Source
The Listeria transcriptional landscape from saprophytism to virulence, Nature, 18 juin 2009.
Alejandro Toledo-Arana(1,2,3), Olivier Dussurget(1,2,3), Georgios Nikitas(2,4,5), Nina Sesto(1,2,3), Hélène Guet-Revillet(1,2,3), Damien Balestrino(1,2,3), Edmund Loh(6,7), Jonas Gripenland(6,7), Teresa Tiensuu(6,7), Karolis Vaitkevicius(6,7), Mathieu Barthelemy(8), Massimo Vergassola(9,10), Marie-Anne Nahori(1,2,3), Guillaume Soubigou(8), Béatrice Régnault(8), Jean-Yves Coppée(8), Marc Lecuit(2,4,5,11), Jörgen Johansson(6,7) & Pascale Cossart(1,2,3).
(1) Institut Pasteur, Unité des Interactions Bactéries-Cellules
(2) Inserm, U604
(3) INRA, USC2020
(4) Institut Pasteur, G5 Microorganismes et Barrières de l’hôte,
(5) Inserm, Avenir, U604
(6) Department of Molecular Biology,
(7) The Laboratory for Molecular Infection Medicine Sweden (MIMS), Umea? University, S-90187 Umea?, Sweden.
(8) Institut Pasteur, Génopole, Plate-forme 2
(9) Institut Pasteur, UP Génétique in silico.
(10) CNRS, URA2171
(11) Université Paris Descartes, Hôpital Necker-Enfants malades, Assistance Publique-Hôpitaux de Paris.
Contacts presse
Service de presse de l’Institut Pasteur
Marion Doucet ou Nadine Peyrolo – 01 45 68 89 28 - presse@pasteur.fr
Service de presse de l’Inserm
Anne Mignot – 01 44 23 60 73 - presse@inserm.fr
Service de presse de l’Inra
Mathilde Maufras – 01 42 75 91 69 – presse@inra.fr