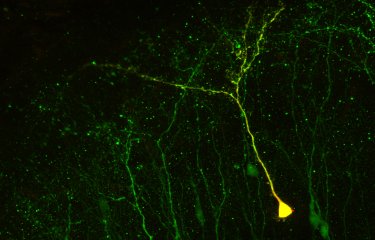
Chez tous les vertébrés, à l’âge adulte, des cellules souches sont recrutées pour produire de nouveaux neurones dans le cerveau. Ces processus, dits d’activation, sont cependant mal connus.
Des scientifiques de l’Institut Pasteur, du CNRS et de l’Université de Tel Aviv, en collaboration avec l’Ecole Polytechnique et l’Inrae, ont pu visualiser en 3D et analyser la distribution spatiale et temporelle de l’activation des cellules souches neurales dans le cerveau d’un modèle vertébré, le poisson zébré.
Leurs observations démontrent pour la première fois que les événements d’activation de ces cellules sont coordonnés dans le temps et dans l’espace. Ces résultats pourraient permettre notamment une meilleure compréhension des processus de régulation engagés dans la formation de tumeurs cérébrales. Ces travaux sont publiés dans la revue Cell Stem Cell, le 5 avril 2021.
Les cellules souches, présentes dans de nombreux organes adultes chez les vertébrés dont l’homme, peuvent proliférer et se différencier pour générer de nouvelles cellules fonctionnelles. Ainsi, les cellules souches du cerveau (cellules souches neurales) produisent de nouveaux neurones à l’âge adulte. Les cellules souches neurales se trouvent la plupart du temps dans un état de repos appelé « quiescence ». Pour produire des neurones, elles doivent donc d’abord s’activer, puis se diviser. Cette étape d’activation est cruciale : nécessaire au recrutement des cellules souches, elle conditionne également leur survie (une cellule qui s’active trop s’épuisera vite), et la position et la nature des neurones formés.
Au sein de leur niche, les cellules souches neurales s’activent puis se rendorment en ordre dispersé et de façon asynchrone, suggérant une possible coordination de ces événements à l’échelle de la population cellulaire. Pour tester cette hypothèse, les scientifiques de l’unité Neurogénétique du poisson zébré[1] à l’Institut Pasteur ont utilisé cet organisme, dont le cerveau adulte possède un grand nombre de cellules souches neurales semblables à celles des mammifères. Par imagerie intravitale (non invasive) biphotonique sur des poissons adultes, ils ont pu filmer les cellules souches dans leur niche pendant plusieurs semaines, et étudier le comportement d’activation de chacune par rapport à celui de ses voisines en temps réel. Une analyse par statistiques spatiales et modélisation, à chaque instant et au cours du temps, a permis de démontrer l’existence d’interactions inhibitrices issues des cellules activées, retardant de plusieurs jours l’activation des autres cellules souches dans leur voisinage. Par administration d’une molécule pharmacologique in vivo, les scientifiques ont également identifié la voie moléculaire impliquée, appelée voie de signalisation Notch. Enfin, ils ont montré que ces interactions permettaient une production neuronale régulière dans le temps et l’espace.
« Il s’agit de la première imagerie en temps réel et à long terme d’une population entière de cellules souches neurales dans le cerveau d’un vertébré adulte. Ces résultats démontrent pour la première fois que les événements d’activation des cellules souches neurales dans le cerveau des vertébrés sont coordonnés dans le temps et dans l’espace au sein de la niche » commente Laure Bally-Cuif, chercheuse CNRS, auteure principale de l’étude et directrice de l’unité Neurogénétique du poisson zébré1 à l’Institut Pasteur. De façon inattendue, cette étude démontre également que les acteurs de cette coordination sont les cellules souches elles-mêmes. Ainsi, ce travail voit l’émergence d’un nouveau concept : celui d’une auto-organisation des populations souches en un système dynamique permettant la coordination spatio-temporelle du comportement de chaque cellule individuelle.
De telles régulations pourraient avoir lieu au sein de masses tumorales contenant des cellules souches cancéreuses, où des cellules souches dans différents états de quiescence ou d’activation ont été observées. Il est également vraisemblable que de telles régulations opèrent aussi dans les populations souches d’autres organes adultes où les cellules souches sont trouvées en niches compactes, comme dans les épithéliums.
Imagerie intravitale des cellules souches neurales d’un poisson zébré pendant 23 jours :
Cette animation montre les cellules souches couvrant un des deux hémisphères cérébraux d’un poisson adulte. Les cellules souches ont été suivies pendant 23 jours afin d’analyser leurs positions, leurs événements d’activation et leur différenciation. Les poissons sont anesthésiés et filmés à l’aide d’un microscope biphotonique tous les 3 jours.
Les points indiquent le centre de chaque cellule et les flèches les cellules souches qui se divisent.
© Nicolas Dray, Laure Mancini and Laure Bally-Cuif, Institut Pasteur
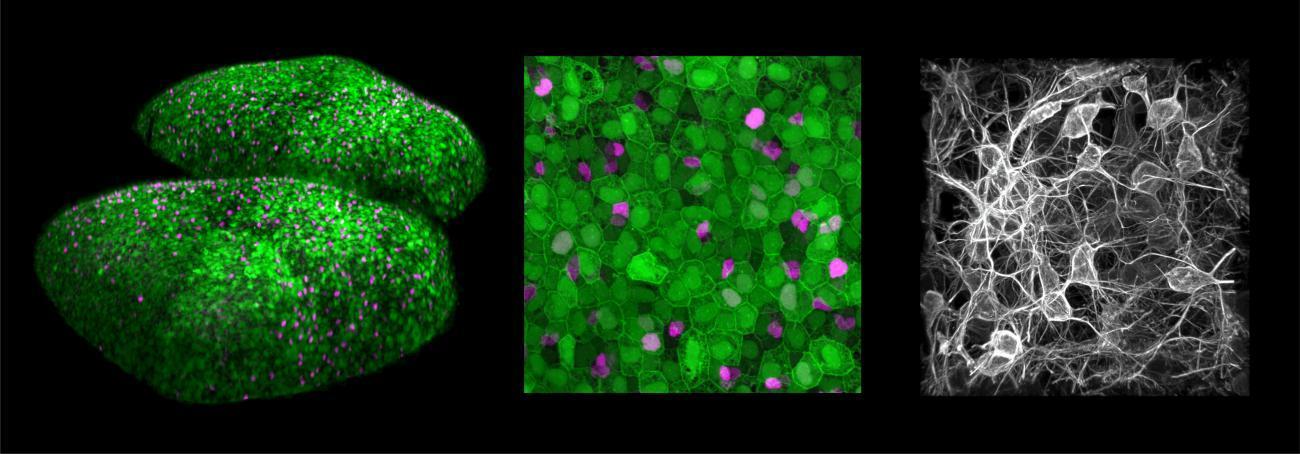
A gauche : Cellules souches neurales recouvrant les deux hémisphères cérébraux d’un poisson zébré adulte. Au milieu : Grossissement permettant d’identifier les cellules souches quiescentes (vertes uniquement), activées (vertes et magenta) et en voie de différenciation (magenta uniquement). A droite : Neurones générés pendant la vie adulte par ces cellules souches.
© Nicolas Dray, Laure Mancini and Laure Bally-Cuif, Institut Pasteur
__________________________
[1] Département Biologie du développement et cellules souches (CNRS / Institut Pasteur)
Source
Dynamic spatiotemporal coordination of neural stem cell fate decisions occurs through local feedback in the adult vertebrate brain, Cell Stem Cell, 5 avril 2021
Nicolas Dray1,*,$, Laure Mancini1,2,*, Udi Binshtok3,*, Felix Cheysson4,5,6,*, Willy Supatto7, Pierre Mahou7, Sébastien Bedu1, Sara Ortica1, Emmanuel Than-Trong1,£, Monika Krecsmarik1, Sébastien Herbert8,9, Jean-Baptiste Masson10, Jean-Yves Tinevez9, Gabriel Lang4, Emmanuel Beaurepaire7, David Sprinzak3,$, Laure Bally-Cuif1,$
1Zebrafish Neurogenetics Unit, Institut Pasteur, UMR3738, CNRS, Team supported by the Ligue Nationale Contre le Cancer, Paris (75015), France
2Sorbonne Université, Collège doctoral, F-75005 Paris, France
3School of Neurobiology, Biochemistry, and Biophysics, The George S. Wise Faculty of Life Sciences, Tel Aviv University, Tel Aviv (69978), Israel
4Université Paris-Saclay, AgroParisTech, INRAE, UMR MIA-Paris, Paris (75005), France
5Epidemiology and Modeling of bacterial Evasion to Antibacterials Unit (EMEA), Institut Pasteur, Paris (75015), France
6Anti-infective Evasion and Pharmacoepidemiology team, Centre for Epidemiology and Public Health (CESP), INSERM/UVSQ, France
7Laboratory for Optics and Biosciences, Ecole Polytechnique, CNRS, INSERM, IP Paris, Palaiseau (91128), France
8Department of Developmental and Stem Cell Biology, Institut Pasteur, Paris (75015), France
9Image Analysis Hub, Institut Pasteur, Paris (75015), France
10Department of Neuroscience and Department of Computational Biology, Institut Pasteur, Paris (75015), France
£Current address: Laboratoire des maladies neurodégénératives, Institut François Jacob, MIRCen, CEA/CNRS UMR 9199, Fontenay-aux-Roses, France
*Equal contribution
$Co-corresponding authors