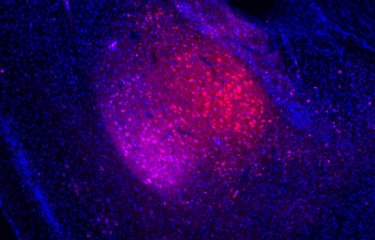
Ces dernières décennies, les maladies neurodégénératives ont rejoint la liste des dix principales causes de décès dans le monde. À l’échelle internationale, des chercheurs déploient des efforts colossaux pour en comprendre la pathogenèse, une étape indispensable au développement de traitements efficaces contre ces pathologies incurables. Cependant, nos connaissances sur les mécanismes moléculaires fondamentaux sous-tendant la pathogenèse des maladies neurodégénératives demeurent insuffisantes. Une équipe de scientifiques a mis à jour l’implication des lysosomes dans la propagation de la maladie de Parkinson.
Plusieurs maladies neurodégénératives se caractérisent par une accumulation d’agrégats de protéines mal repliées dans les régions cérébrales affectées. Des preuves accumulées sur des modèles cellulaires et animaux mettent en évidence la capacité de différentes protéines mal repliées à être transmises et à induire l’agrégation de leurs homologues endogènes dans le cadre d’un processus appelé « ensemencement ». Chez Parkinson, deuxième maladie neurodégénérative la plus fréquente, les protéines α-synucléine (α-syn) mal repliées forment, à l’intérieur des neurones, des agrégats fibrillaires connus sous le nom de « corps de Lewy ».
Les TNT comme voie de propagation des fibrilles d’α-syn à l’intérieur des lysosomes
En 2016, une équipe de chercheurs de l’Institut Pasteur (Paris) et du CNRS (Centre national de la recherche scientifique) a démontré que les fibrilles d’α-syn se propageaient des cellules donneuses aux cellules receveuses via des « tunneling nanotubes » (TNT). Elle a également découvert que des TNT transféraient ces fibrilles à l’intérieur des lysosomes. « Les TNT sont des canaux membranaires basés sur l’actine qui permettent le transfert de plusieurs composants cellulaires, dont des organites, entre des cellules distantes. Les lysosomes sont des organites normalement voués à la dégradation et au recyclage du matériel cellulaire toxique / endommagé », explique Chiara Zurzolo, responsable de l’unité Trafic membranaire et pathogenèse de l’Institut Pasteur.
Des fibrilles d’α-syn capables de modifier la forme et la perméabilité des lysosomes pour permettre leur ensemencement et leur diffusion
Suite à cette découverte originale, les chercheurs apportent aujourd’hui quelques éclairages sur le rôle des lysosomes dans la propagation des agrégats d’α-syn via les TNT. « La microscopie électronique super-résolutive nous a permis de constater que les fibrilles d’α-syn influaient sur la morphologie des lysosomes et altéraient leur fonction dans les cellules neuronales. Nous avons établi pour la première fois que les fibrilles d’α-syn induisaient la redistribution périphérique des lysosomes, ce qui accroît l’efficacité de leur transfert aux cellules voisines », ajoute Chiara Zurzolo. Les scientifiques ont également montré que les fibrilles d’α-syn pouvaient perméabiliser la membrane lysosomale, altérant la fonction de dégradation des lysosomes et permettant l’ensemencement d’α-syn solubles, principalement dans ces lysosomes. Par conséquent, en altérant la fonction lysosomale, les fibrilles d’α-syn bloquent leur propre dégradation dans les lysosomes, qui deviennent alors le point central de la propagation de la maladie.
en altérant la fonction lysosomale, les fibrilles d’α-syn bloquent leur propre dégradation dans les lysosomes, qui deviennent alors le point central de la propagation de la maladie.
Cette découverte contribue au décryptage du mécanisme de propagation des fibrilles d’α-syn via les TNT et dévoile le rôle crucial des lysosomes, qui agissent tels des chevaux de Troie dans l’ensemencement et la propagation de la pathologie. Elle peut être utilisée aux fins du développement de nouveaux traitements ciblant ces maladies incurables.
Cette étude entre dans le cadre de l’axe scientifique prioritaire Maladies de la connectivité cérébrale et maladies neurodégénératives du plan stratégique 2019-2023 de l’Institut Pasteur.
Ce projet a reçu un financement du programme de recherche et d'innovation Horizon 2020 de l'Union européenne dans le cadre de la convention de subvention Marie Skłodowska-Curie n° 897378.
Source :
α-Synuclein fibrils subvert lysosome structure and function for the propagation of protein misfolding between cells through tunneling nanotubes, Plos Biology, 20 juillet 2021
Aysegul Dilsizoglu Senol1§, Maura Samarani1§, Sylvie Syan1, Carlos M. Guardia2, Takashi Nonaka3, Nalan Liv4, Patricia Latour Lambert5, Masato Hasegawa3, Judith Klumperman4, Juan S. Bonifacino2, Chiara Zurzolo1*
1 Unité Trafic membranaire et pathogenèse, Département Biologie cellulaire et infection, Institut Pasteur, Paris, France.
2 Neurosciences and Cellular and Structural Division, Eunice Kennedy Shriver National Institute of Child Health and Human Development, National Institutes of Health, Bethesda, MD, États-Unis.
3 Dementia Research Project, Tokyo Metropolitan Institute of Medical Science, Tokyo, Japon.
4 Section Cell Biology, Center for Molecular Medicine, University Medical Center Utrecht, Université d’Utrecht, Utrecht, Pays-Bas.
5 Dynamique des interactions hôte-pathogène, Département Biologie cellulaire et infection, Institut Pasteur, Paris, France.
§ Ces auteurs ont contribué à part égale.