Mise à jour - Juin 2022
Les études épidémiologiques actuelles estiment qu’environ 1% de la population mondiale pourrait recevoir le diagnostic d’autisme. De nombreuses études ont mis en évidence une forte contribution génétique à ce trouble et plus de 200 gènes y ont été associés. Les défis actuels sont à la fois d’améliorer le diagnostic précoce et de proposer des parcours d’accompagnement voire de soins, lorsque nécessaires, tenant compte des aptitudes et des difficultés de chaque individu.
Historique
L’autisme a été décrit pour la première fois par les psychiatres Leo Kanner, en 1943, et Hans Asperger, en 1944. Depuis, la définition de l’autisme et ses critères diagnostiques ont évolué et les mécanismes biologiques impliqués, principalement génétiques, sont de mieux en mieux connus. Dès les années quatre-vingt, la psychiatre britannique Lorna Wing rompt avec la conception de l’autisme comme une entité binaire (soit présent, soit absent) et suggère que l’autisme correspond davantage à un ensemble de symptômes dont l’intensité se situe sur un continuum. Par exemple, si l’on considère la communication sociale, les troubles peuvent varier d’une difficulté dans l’établissement des interactions avec autrui à un retrait social majeur. Avec cette nouvelle approche, Lorna Wing a émis l’hypothèse que l’autisme serait une condition plus fréquente qu’on ne le supposait à l’époque.
Causes
Pour la majorité des personnes autistes, il n'existe pas une seule cause identifiée via un examen médical. Certains facteurs environnementaux ont été mis en évidence : neuro-inflammation, virus, prise de certains médicaments (cf. Dépakine) durant la grossesse... Cependant, ni les vaccins, ni la maladie cœliaque, ni les caractéristiques psychologiques des parents ne sont facteurs de risques d'autisme chez les enfants. La composante génétique prédomine avec, dans certains cas, une seule mutation responsable de l’autisme qui peut apparaître de novo — c’est-à-dire apparaître chez l’enfant alors qu’elle était absente chez les parents. Dans d’autres cas, c’est la combinaison de plusieurs variations génétiques qui vont augmenter la probabilité de développer un autisme. En plus des 200 gènes déjà associés à l’autisme, de nouveaux gènes sont régulièrement identifiés. Les études ont également révélé qu'une part importante des variations génétiques associées à l'autisme sont partagées par d'autres conditions telles que les troubles de l’attention avec ou sans hyperactivité (TDA/H) et la déficience intellectuelle.
Épidémiologie
Selon les définitions, la prévalence des troubles du neurodéveloppement (TND) dans le monde varie de 5 à 15%, selon un gradient de sévérité des troubles très large. Les données officielles estiment que plus d’1 personne sur 100 pourrait recevoir un diagnostic d’autisme. Pour des raisons encore mal déterminées, les garçons sont plus fréquemment diagnostiqués avec un autisme (4 garçons pour 1 fille). De récentes études ont été menées pour mieux identifier l'expression de l'autisme, mais aussi les diagnostics différentiels chez les filles et femmes autistes. La probabilité d’avoir un enfant autiste est 10 à 20 fois plus élevée dans les familles où les parents ont déjà eu un enfant autiste. De plus, les jumeaux monozygotes (« vrais jumeaux ») partagent le diagnostic d’autisme plus fréquemment que les jumeaux dizygotes (« faux jumeaux »).
À LIRE AUSSI
Classification
Les classifications de référence (CIM et DSM) et le diagnostic de l’autisme sont en constante évolution. Ce dernier est aujourd’hui intégré au sein de la catégorie des troubles du neurodéveloppement (TND), au même titre que les trouble du déficit de l’attention avec ou sans hyperactivité (TDA/H), la déficience intellectuelle, les troubles de la coordination motrice, ou les troubles spécifiques des apprentissages. Le neurodéveloppement désigne l’ensemble des mécanismes qui vont guider la façon dont le cerveau se développe, orchestrant les fonctions cérébrales (fonctions motrices, exécutives, d’intégration sensorielle, langagières, émotionnelles, de raisonnement, etc.). Il s’agit d’un processus dynamique, influencé par des facteurs génétiques et environnementaux. Le neurodéveloppement débute très précocement, dès la période prénatale, pour se poursuivre jusqu’à l’âge adulte. Ce flux maturatif modifie chaque jour les capacités de l’enfant. Il est plus ou moins rapide selon les individus. Ces processus développementaux peuvent montrer un certain degré de diversité et dans certains cas conduire à un TND.
Diagnostic
Le diagnostic de l’autisme est clinique. Il est basé sur une évaluation multidimensionnelle précise, détaillée et individualisée, portant sur les différents aspects du développement et du fonctionnement de l’individu ainsi que sur son environnement, et ce, dans des contextes variés.
Cette évaluation relève d’une démarche coordonnée entre la personne, sa famille/ses proches et les professionnels concernés, et permet d’établir le projet d’accompagnement personnalisé. Elle repose sur :
- Des observations recueillies à l’aide de questionnaires auprès des proches de la personne (en particulier ses parents, dans la mesure du possible) mais aussi auprès des professionnels qui l’entourent au quotidien — dans les divers lieux de vie qu’il ou elle fréquente, à la crèche, à l’école, ou au travail, pour les plus âgés.
- Des tests standardisés (tests de langage, des habiletés motrices, etc.) appropriés à l’âge de l’individu, à son profil de développement, à son comportement et au contexte de test, tout en privilégiant les tests et échelles validés (recommandation de la Haute Autorité de Santé).
À noter, l'importance du fonctionnement perceptif et du mode de pensée des personnes autistes, qui revêtent des spécificités particulièrement étudiées.
Symptômes
Une personne autiste peut présenter à tout âge la totalité ou une partie de ces symptômes fréquents, non exhaustifs :
- champs d'activités / d’intérêts restreints
- difficultés à s’intégrer socialement (retrait social ou, à l'inverse, sollicitations sociales présentes, voire nombreuses, mais considérées comme inadaptées)
- trouble de la communication non verbale (par exemple, évitement du contact visuel)
- difficulté à comprendre/déceler les sentiments d’autrui
- langage absent ou troubles du langage ou retard de langage, ou, au contraire, développement typique du langage, voire précoce (avec un langage riche et un lexique élaboré, mais une communication « particulière »)
- tendance à répéter des syllabes, mots ou expressions stéréotypées (écholalies)
- comportements répétitifs (ex. balancements, torsion de membres)
- difficulté à s’adapter aux changements de routine / d'environnement
- hyper- ou hypo-sensorialité (aux sons, à la lumière, aux odeurs, aux goûts etc.)
Troubles associés
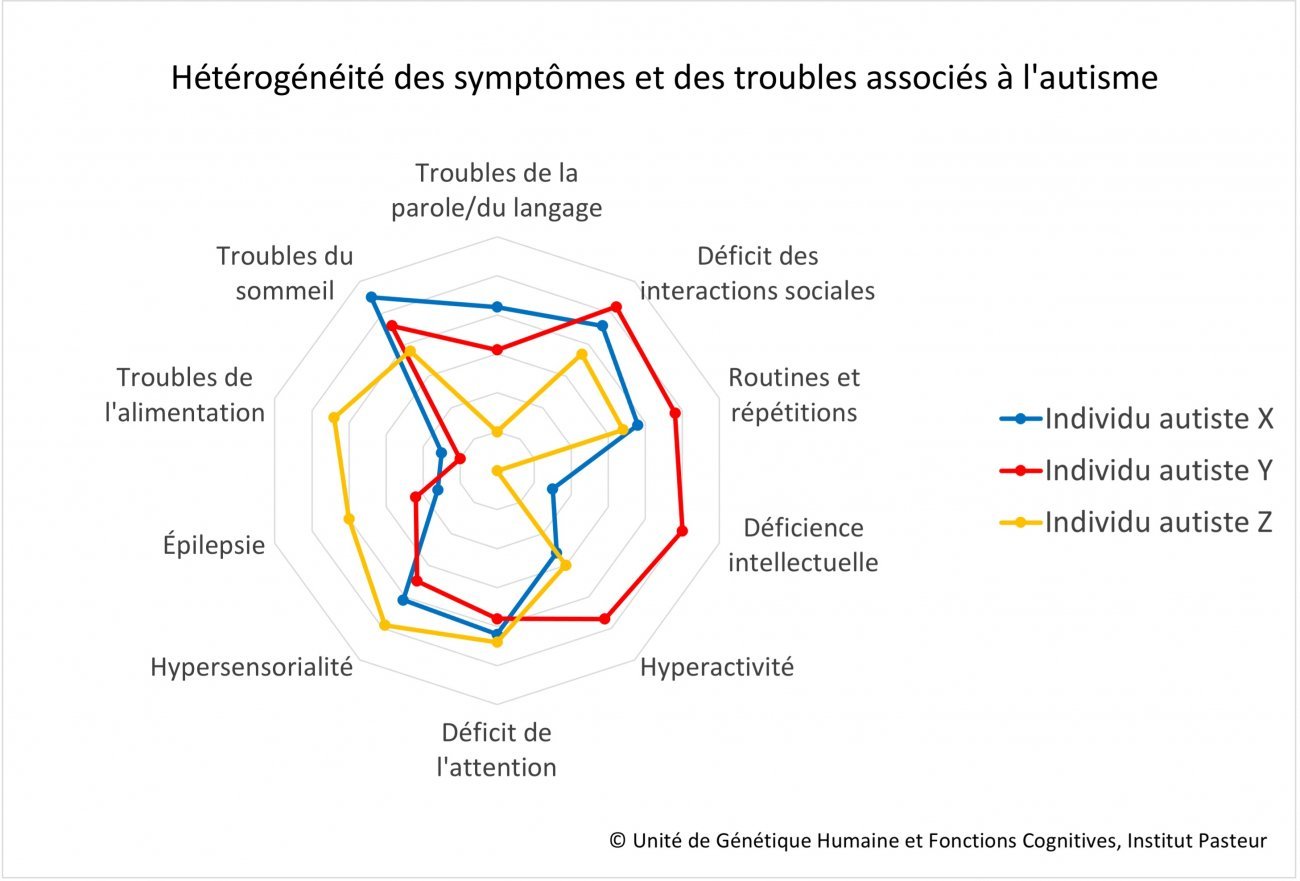
L’autisme est également fréquemment associé à d’autres TND, tels que le trouble du déficit de l’attention avec ou sans hyperactivité (TDA/H), les troubles du développement de la coordination, les troubles spécifiques des apprentissages ou la déficience intellectuelle, mais aussi à des troubles psychiatriques tels que les troubles anxieux (en particulier la phobie sociale ou le trouble anxieux généralisé), la dépression, les troubles bipolaires, voire schizophréniques, ou encore à certaines maladies telles que l’épilepsie ou le reflux gastro-œsophagien. Il est également fréquent que les personnes autistes présentent des troubles du sommeil et/ou de l’alimentation.
Ce n’est malheureusement que très récemment que ces troubles associés ont été pris en compte dans la recherche. Ils sont en effet extrêmement importants, tant pour comprendre l’origine de l’autisme que pour améliorer l’accompagnement des personnes concernées.
Approches et interventions
La première question qui doit se poser est d’identifier correctement sur le plan anatomique, biologique, neurologique et clinique les manifestations de l'autisme. S'en suivent alors les propositions qui peuvent être faites aux personnes et à leurs proches en termes d'interventions.
Il n’existe à ce jour aucune « méthode » absolue et exclusive, ni aucun traitement médicamenteux qui puissent prétendre « guérir » de l'autisme. Cependant, il est avéré que la combinaison d'interventions d'ordre éducatif, cognitivo-comportemental et développemental permettent de compenser des difficultés, de réguler certains états et de potentialiser les aptitudes de la personne. Ces interventions peuvent concerner toute personne autiste et doivent avant tout favoriser son développement et minorer ses difficultés fonctionnelles au quotidien pour améliorer sa qualité de vie.
La prise en charge de l’autisme est uniquement symptomatique (ce sont les symptômes qui sont traités et non les origines du trouble) et passe donc actuellement par des stratégies thérapeutiques non médicamenteuses personnalisées&bnsp;: rééducation orthophonique, psychoéducation, rééducation psychomotrice... Ces dernières sont d’autant plus efficaces lorsqu’elles sont appliquées à un stade précoce du développement de l’individu. Plusieurs essais thérapeutiques, médicamenteux ou non, sont également en cours pour identifier d'autres stratégies thérapeutiques.
À l’Institut Pasteur
À l’Institut Pasteur, l’unité de recherche Génétique humaine et fonctions cognitives dirigée par Thomas Bourgeron, professeur à Université Paris Cité, réalise des recherches multidisciplinaires regroupant des expertises en génétique et en imagerie cérébrale structurale et fonctionnelle afin de mieux comprendre le fonctionnement du cerveau et les troubles du neurodéveloppement. L’unité a été la première à confirmer la piste génétique de l’autisme en identifiant, en 2003, des mutations affectant deux gènes localisés sur le chromosome X et appelés NLGN3 et NLGN4X. Depuis, d’autres gènes associés à l’autisme ont été mis en évidence par l’équipe.
Les travaux actuels de l’unité se concentrent sur :
- L’identification de nouveaux gènes de vulnérabilité à l’autisme et la caractérisation de leurs spécificités ;
- La caractérisation de sous-groupes de personnes autistes en incluant des données de séquençage complet du génome et d’imagerie cérébrale ;
- La compréhension des mécanismes biologiques de l’autisme, entre autres ceux impliqués dans la connectivité du cerveau et dans les déficits en mélatonine (en lien avec les troubles du sommeil, présents chez plus de la moitié des personnes autistes) ;
- La compréhension des raisons pour lesquelles certains individus sont résilients aux conséquences sévères de certaines mutations génétiques, c’est-à-dire qu’ils n’ont pas (ou peu) de symptômes, alors qu’ils sont porteurs de mutations connues pour être impliquées dans les TND.
Les travaux en collaboration avec le centre d’Excellence InovAND de l’hôpital Robert-Debré
De meilleurs diagnostics
Plusieurs projets sont engagés en étroite collaboration entre l’Institut Pasteur et le centre d’Excellence InovAND localisé au sein de l’hôpital universitaire Robert-Debré (AP-HP) et dirigé par le professeur Richard Delorme. Au sein du service de pédopsychiatrie, les familles sont accueillies dans les unités pour évaluer les enfants et leur proposer des parcours d’accompagnement individualisés. Les analyses des génomes complets sont effectuées par le service de génétique (Dr Anne-Claude Tabet). Plusieurs projets sont en cours pour mieux comprendre la récurrence et les premiers signes de l’autisme chez les jeunes enfants ainsi que les liens avec les particularités neuro-anatomiques et génétiques identifiées. Les parents et les frères et sœurs sont également, s’ils le souhaitent, évalués dans le même service (évaluation des antécédents médicaux et psychiatriques, entretien clinique de recherche, évaluation cognitive) afin de mieux comprendre la transmission des gènes associés à l’autisme au sein des familles. Un projet spécifique pour les familles comportant plus d’une personne autiste ou ayant un TND a été récemment mis en place (projet Familles “multiplexes”).
Des essais cliniques ciblés
Bien qu’il n’existe actuellement aucun traitement médicamenteux pour les personnes présentant un autisme ou autre TND, la recherche suggère que les conséquences délétères de certaines mutations pourraient être réduites, même chez l’adulte. Un essai clinique a débuté en 2022 à l’hôpital Robert-Debré pour des autistes avec déficience intellectuelle porteurs de mutations du gène SHANK3 précédemment identifiées à l’Institut Pasteur. À l’aide de cellules de peau des patients reprogrammées en neurones (cellules souches pluripotentes induites iPSC), l’équipe d’Alexandra Benchoua à l’I-Stem a effectué un criblage à haut débit de 202 molécules pharmacologiques qui a permis l'identification d’un élément chimique pouvant restaurer le niveau d'expression du gène SHANK3, le lithium. L’essai clinique randomisé a pour objectif principal d’évaluer l’effet du lithium à 12 semaines chez les personnes présentant un syndrome de Phelan McDermid, une forme d’autisme dont la très grande majorité des patients sont mutés dans le gène SHANK3. Son effet positif sur les symptômes du déficit social pourrait représenter une nouvelle perspective pour d’autres formes syndromiques d’autisme. Des essais thérapeutiques avec d’autres molécules sont en cours, notamment dans le cadre du projet européen AIMS-2-Trials (voir ci-dessous).
Les projets de recherche européens : AIMS-2-Trials et CANDY
Le projet AIMS-2-Trials est financé par l’Union Européenne et regroupe 48 partenaires académiques et industriels. Il a pour objectif d’identifier de nouveaux biomarqueurs de l’autisme, permettant d’améliorer le diagnostic, d’une part, et l’élaboration de traitements et de méthodes d’accompagnement personnalisé, d’autre part. Des essais thérapeutiques mettant en jeu différentes molécules (par exemple l’arbaclofen) sont en cours dans le cadre de ce consortium.
Le projet européen CANDY a des objectifs similaires au projet AIMS-2-Trials mais s'intéresse en plus aux conditions comme les troubles du déficit de l’attention avec ou sans hyperactivité (TDA/H) et l'épilepsie, présentes plus fréquemment chez les personnes autistes qu’au sein de la population générale. Ces projets incluent des milliers de participants, à la fois des nouveau-nés, des enfants et des adultes, et suivent leur développement sur plusieurs années. Dans le cadre de ces projets, des données cliniques, génétiques et d’imagerie cérébrale sont collectées, ce qui permettra d’acquérir une compréhension d’ensemble de l’autisme, à différentes échelles. Cette quantité de données sans précédent dans les études sur l’autisme en Europe devrait permettre d’identifier des sous-groupes d’autistes et de contribuer à la découverte de traitements et d’accompagnements qui leur soient adaptés. L’équipe de l’Institut Pasteur est responsable des analyses génétiques et de l’hébergement de la base de données de ces deux projets.
La recherche en génétique, quels bénéfices pour les personnes autistes ?
La recherche en génétique est bénéfique pour les personnes autistes car elle permet :
- Une réduction de l’errance diagnostique. Mieux les mutations génétiques causales seront connues, plus précis et plus rapides seront les diagnostics.
- Une amélioration fonctionnelle du quotidien des personnes. L’analyse du génome permet de déterminer les risques pour les personnes autistes de développer un trouble associé tel qu’une anomalie du métabolisme, une épilepsie ou un trouble du sommeil (voir plus bas « L’apport de la génétique dans l’amélioration des troubles du sommeil »). Détecter ces risques permet aux personnes de bénéficier précocement de traitements spécifiques. Par exemple, les retards des apprentissages causés par certains gènes associés à l’autisme et aux TND peuvent aussi être réduits par des régimes alimentaires appropriés comme dans le cas de maladies métaboliques comme la phénylcétonurie, le déficit dans le transport de la créatine ou encore dans la synthèse de carnitine.
- Également, connaître les mutations en cause du trouble chez un individu donné peut permettre de l’intégrer à un essai clinique ciblé ayant pour objectif d’évaluer l’efficacité d’un traitement médicamenteux et/ou d’un accompagnement éducatif pour des personnes autistes porteuses de mutations similaires. Par exemple, nous effectuons actuellement un essai clinique visant à tester l’effet du lithium sur la réduction des symptômes de personnes autistes avec déficience intellectuelle porteuses d’une mutation dans le gène SHANK3 (voir plus haut « Des essais cliniques ciblés » / Les travaux en collaboration avec le centre d’Excellence InovAND de l’hôpital Robert-Debré).
La nécessité d’une recherche participative
La recherche sur l’autisme a montré l’importance d’intégrer des données cliniques, génétiques et neurobiologiques (imageries cérébrales), mais aussi le « savoir expérientiel » des personnes, des données issues de leur vie réelle. Pour répondre à leurs questionnements et à leurs besoins quotidiens, mais aussi à leurs envies, il est impératif que la recherche soit participative — c’est-à-dire que les personnes autistes et les personnes impliquées dans leur quotidien y aient un rôle d’acteurs au même titre que les chercheurs et les médecins. Plusieurs initiatives ont été lancées au niveau national et au niveau européen afin d’identifier avec tous les acteurs les points majeurs à améliorer dans la recherche. Les projets de recherche co-développés sont encore peu nombreux mais les deux grands projets européens AIMS-2-Trials et CANDY ont chacun un groupe de travail dédié à la science participative. Le projet AIMS-2-Trials a notamment mis en place des questionnaires à destination des personnes autistes et des aidants, afin de contribuer à un meilleur partage des connaissances entre scientifiques et personnes directement concernées par l’autisme. Au niveau national, le groupe d’intérêt scientifique (GIS) Autisme et troubles du neurodéveloppement a mis en place un groupe de réflexion des associations de personnes concernées pour la science (GRAPS). Les questions qui concernent les recherches menées font l’objet d’un intérêt et de préoccupations grandissantes de la part des personnes en situation de handicap. Un projet européen qui débutera en septembre 2022, Risk, Resilience and Developmental Diversity in Mental Health (R2D2-Mental Health), coordonné par l’unité Génétique humaine et fonctions cognitives de l’Institut Pasteur, a décidé de faire du co-développement un de ses objectifs clés. L’expertise des personnes autistes et de leurs familles est clef pour comprendre les besoins des personnes autistes dans leur vie quotidienne et améliorer leur bien-être.
Chez la personne autiste, les troubles du sommeil sont cliniquement repérés depuis longtemps. Les différentes études menées vont dans le sens d’une corrélation entre troubles du sommeil et sévérité des symptômes spécifique à l’autisme et des troubles associés.
L’unité Génétique humaine et fonctions cognitives à l’Institut Pasteur, en collaboration avec d’autres centres, a découvert en 2007 des variations génétiques impactant la fonction du gène appelé ASMT, qui code l’enzyme de la voie de synthèse de la mélatonine (hormone qui régule les rythmes biologiques circadiens). Un taux bas de mélatonine chez les personnes autistes avait déjà été rapporté par trois équipes indépendantes, mais la cause du déficit n’était pas connue. Les chercheurs de l’Institut Pasteur ont observé que plus de la moitié des enfants autistes avaient des taux bas de mélatonine et que cette faible concentration était corrélée à un déficit de l’enzyme ASMT. Depuis, les stratégies éducatives et l’utilisation de la mélatonine se sont développées pour contribuer à améliorer la qualité du sommeil et donc la qualité de vie des personnes autistes, ainsi que de leurs proches.
ILLUSTRATION à venir
Juin 2022
D'autres liens utiles :
En français :
- Handicap.gouv.fr
- Engagement 1 de la Stratégie Nationale Autisme 2018/2022 consacrée à la Science
- Autisme Info Service
- Groupement National des Centres de Ressources Autisme
- Autisme France
- Autisme Europe
- Deux minutes pour mieux vivre l’autisme
- Comprendre l’autisme
- Association française du Syndrome de Phelan-McDermid
- CléPsy
En anglais :
Cette fiche a été co-rédigée avec le service de psychiatrie de l’Hôpital Robert-Debré de Paris et l’association PAARI Personnes Autistes pour une Autodétermination Responsable et Innovante.






