Les stratégies d’immunothérapie visent à utiliser le système immunitaire du patient pour que ses propres cellules détruisent les cellules cancéreuses. Le traitement par cellules CAR-T est une de ces immunothérapies cellulaires efficaces pour le traitement des cancers du sang. Les cancers du sang touchent chaque année environ 35 000 personnes en France et 1,24 million de cas dans le monde. En étudiant de près les cellules immunitaires, lymphocytes T CD4, générées dans le cadre de cette thérapie, des chercheuses et chercheurs de l’Institut Pasteur, de l’Inserm, en collaboration avec des cliniciens de l’AP-HP ont découvert la capacité de ces lymphocytes à neutraliser des cellules tumorales à distance grâce à la production d’interféron gamma (interféron-γ). Cette étude nourrit de nouveaux espoirs pour les patients atteints de cancers du sang ayant une réponse non complète à la thérapie par cellules CAR-T et pour les cancers sensibles à l’interféron-γ. Ces résultats ont été publiés le 29 mai 2023 dans la revue Nature Cancer.
La thérapie par cellules CAR-T est une immunothérapie qui a démontré des résultats remarquables pour traiter certaines leucémies ou certains lymphomes. Cependant, certains patients ayant reçu ce traitement rechutent à cause d’un échappement des cellules cancéreuses à cette thérapie. Une équipe pluridisciplinaire de scientifiques de l’Institut Pasteur, de l’Inserm et de cliniciens de l’AP-HP a cherché à mieux comprendre comment fonctionnait cette thérapie dans le but d’obtenir des réponses encore plus efficaces.
Le principe de la thérapie par cellules CAR-T consiste à isoler les lymphocytes T du patient, à les modifier génétiquement pour qu’ils ciblent spécifiquement les cellules cancéreuses et à les multiplier avant de les réinjecter en grand nombre au patient. Cette armée de cellules tueuses CAR-T est constituée de lymphocytes T CD4 et T CD8 en des proportions variables d’un patient à l’autre. Alors que l’on sait que les cellules tueuses CD8 doivent entrer en contact direct avec les cellules cancéreuses pour les détruire, le mode d’action des CD4 avait été peu exploré jusqu’à présent.
En étudiant plus précisément ces cellules CAR-T CD4, l’équipe de recherche a mis en évidence une propriété très intéressante : leur capacité à tuer des cellules cancéreuses à distance en sécrétant une molécule impliquée dans la réponse immunitaire, l’interféron-gamma (interféron-γ).
« Pour certains cancers sensibles à l’interféron-γ, ce mode de destruction est très efficace. Nous avons pu constater que, parmi les patients qui ont beaucoup de CD4, ceux qui produisent beaucoup d’interféron-γ montrent de meilleures réponses au traitement », explique Philippe Bousso, Directeur de l’unité Dynamiques des réponses immunes à l’Institut Pasteur (Inserm 1223) et auteur principal de l’étude.
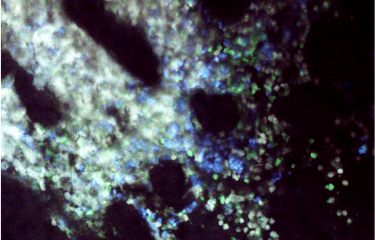
Pour révéler le mécanisme d’action original de ces cellules tueuses à distance, les scientifiques ont d’abord exploré des modèles pré-cliniques pour analyser en détails ce mécanisme, en utilisant notamment des techniques d’imagerie in vivo, puis ont vérifié la pertinence des résultats sur des prélèvements issus de patients.
Attaque d’une tumeur par des cellules CAR T visualisée grâce à l’imagerie intravitale. Les cellules cancéreuses vivantes apparaissent en blanc, les cellules cancéreuses tuées en bleu et les cellules CAR T en vert. Les cercles blancs indiquent la destruction de cellules cancéreuses lors de contacts directs avec les cellules CAR T, les cercles rouges indiquent les destructions de cellules cancéreuses qui se produisent à distance. © Morgane Boulch, Philippe Bousso / Institut Pasteur
« Cette découverte fournit des pistes d’ajustement des traitements pour éviter l’échappement des cellules cancéreuses au traitement par la thérapie CAR-T. Et elle soulève de nouveaux espoirs thérapeutiques pour les patients avec la possibilité de personnaliser davantage la thérapie, selon la sensibilité des cellules cancéreuses, en activant l’interféron-γ grâce une plus grande quantité de CAR-T CD4, » commente Philippe Bousso.
La meilleure compréhension du fonctionnement de ces cellules tueuses T CD4 offre également la possibilité d’étendre le champ d’application de cette thérapie à d’autres cancers à tumeurs solides, et sensibles à l’interféron-γ. Ces données cliniques seront amenées à être confirmées sur d’autres cohortes.
Ces travaux sont financés par les instituts cités plus haut, ainsi que par l’Inca et le Conseil européen de la recherche.
Source
Tumor-intrinsic sensitivity to the pro-apoptotic effects of IFN-γ is a major determinant of CD4+ CAR T-cell antitumor activity, Nature Cancer, 29 mai 2023
Morgane Boulch1, Marine Cazaux1, Alexis Cuffel 2,3, Marion V. Guerin1, Zacarias Garcia1, Ruby Alonso1, Fabrice Lemaître1, Alexander Beer1, Béatrice Corre1, Laurie Menger4, Capucine L. Grandjean1, Florence Morin2, Catherine Thieblemont5, Sophie Caillat-Zucman2,3 & Philippe Bousso1
1 Institut Pasteur, Université de Paris Cité, INSERM U1223, Equipe Labellisée Ligue Contre le Cancer, Paris, France.
2 Université de Paris Cité, Hôpital Saint-Louis, AP-HP Nord, Laboratoire d’Immunologie, Paris, France.
3 INSERM UMR976, Institut de Recherche St-Louis, Paris, France.
4 Gustave Roussy, Villejuif, France ; INSERM U1015, Villejuif, France.
5 Service d’Hémato-Oncologie, Hôpital Saint-Louis, AP-HP, Université de Paris Cité, Paris, France.