Plus de 50 000 greffes de cellules souches dérivées de la moelle osseuse sont réalisées chaque année dans le monde pour traiter de nombreuses pathologies, dont des maladies du cerveau. Avant la transplantation des cellules, les patients reçoivent une chimiothérapie qui permet de détruire les cellules immunitaires et d’éviter ainsi que les cellules greffées ne soient rejetées par l’organisme. Jusqu’ici, les conséquences d’un tel traitement sur le cerveau étaient mal connues. Dans une nouvelle étude, des chercheurs et chercheuses de l’Inserm, du CNRS et de l’Institut Pasteur[1] regroupés au sein de l’Institut du cerveau (Inserm/CNRS/Sorbonne Université) et du laboratoire « Gènes, synapses et cognition » (CNRS/Institut Pasteur) se sont intéressés à cette problématique. A partir d’un modèle animal, ils ont découvert comment la chimiothérapie pré-transplantation facilitait le remplacement des cellules immunitaires innées du cerveau, la microglie, par d’autres cellules immunitaires issues des cellules souches greffées (les macrophages). Ces résultats font l’objet d’une publication dans Nature Medicine le 21 février 2022.
De nombreuses pathologies du cerveau entraînent la démyélinisation[2] progressive du système nerveux central avec des symptômes neurologiques dévastateurs et un risque de décès prématuré (c’est le cas par exemple de la leucodystrophie). La thérapie génique visant à corriger les mutations génétiques à l'origine de la maladie directement dans les cellules souches de la moelle osseuse, et leur autogreffe ultérieure chez les patients, s’est développée ces dernières années et représente aujourd’hui un traitement de choix pour plusieurs de ces pathologies.
Des études cliniques ont montré que le recours à une chimiothérapie avant la transplantation des cellules souches de la moelle osseuse, à l’aide d’un agent de chimiothérapie appelé busulfan, permet une prise de greffe efficace et une tolérance de l’organisme aux cellules génétiquement modifiées. Toutefois, de nombreuses interrogations persistent encore, notamment concernant les mécanismes en jeu et l’impact de ce traitement pré-transplantation sur le cerveau des patients.
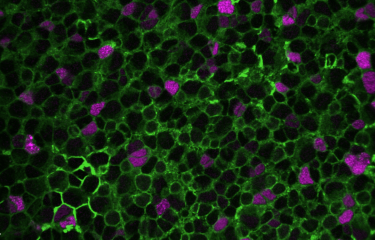
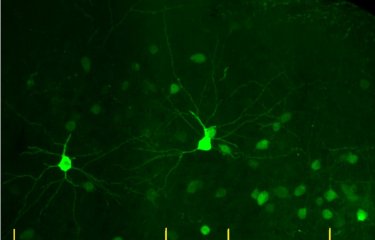
C’est pourquoi les scientifiques ont ici étudié les conséquences de ce traitement sur diverses populations cellulaires du cerveau, dans un modèle animal. Ils se sont notamment intéressés aux cellules microgliales, des cellules immunitaires cérébrales qui sont essentielles au maintien d'une physiologie cérébrale saine dans les états normaux et pathologiques. Ces cellules présentent une forte capacité d'auto-renouvèlement tout au long de la vie.
Dans leurs travaux, les scientifiques montrent qu'après une chimiothérapie par busulfan, les cellules microgliales perdent complètement cette capacité régénérative, et que nombre de ces cellules meurent par sénescence[3].
Toutefois, ce processus ne serait pas délétère pour le cerveau, puisqu’après la greffe, les cellules disparues sont rapidement remplacées par des cellules dérivées de la moelle osseuse (les macrophages). Les cellules microgliales éliminées à cause de la chimiothérapie par busulfan laissent en effet des niches vides dans le cerveau que les macrophages dérivés de la moelle osseuse ne tardent pas à combler. Ces macrophages adoptent alors la morphologie et le comportement de la microglie normale. De futures études viseront à déterminer si ces macrophages adoptent l’ensemble des propriétés des cellules microgliales endogènes au cerveau.
« Les cellules microgliales jouent un rôle essentiel dans le fonctionnement du cerveau et dans la physiopathologie de nombreuses maladies neurologiques sévères, génétiques, mais aussi complexes, comme la sclérose en plaque ou la maladie d’Alzheimer. Comprendre le devenir de ces cellules après le processus de greffe est essentiel à la fois pour préciser les conséquences de la chimiothérapie et pour développer de nouvelles stratégies thérapeutiques pour de graves maladies neurodégénératives », précise Nathalie Cartier, directrice de recherche à l’Inserm et de l’équipe NeuroGenCell à l’Institut du cerveau (ICM), et dernier coauteur de l’étude.
« Cette étude met pour la première fois en lumière un mécanisme expliquant comment des macrophages dérivés de cellules souches, pénètrent le cerveau après une transplantation de cellules de moelle osseuse. Cette meilleure compréhension est essentielle pour développer de nouvelles stratégies de thérapie génique et cellulaire appliquée aux maladies du système nerveux central », souligne Pierre-Marie Lledo, directeur de recherche au CNRS et responsable de l’unité Perception et mémoire au sein du laboratoire « Gènes, synapses et cognition » (CNRS/Institut Pasteur) et dernier coauteur de l’étude.
[1] Ces travaux ont été dirigés par NeuroGenCell, une équipe de l’Institut du Cerveau (ICM, Inserm/CNRS/Sorbonne Université) et une équipe du laboratoire « Gènes, synapses et cognition » (CNRS/Institut Pasteur).
[2] Destruction de la gaine de myéline qui entoure et protège les prolongements (axones) des neurones.
[3] La sénescence est le processus de vieillissement biologique se traduisant par un arrêt irréversible du cycle cellulaire, entrainant la mort des cellules.
Source
Hematopoietic stem cell transplantation chemotherapy causes microglia senescence and peripheral macrophage engraftment in the brain, Nature Medicine, 21 février 2022
Kurt A. Sailor1,†, George Agoranos1, Sergio López-Manzaneda2,3,*, Satoru Tada2,3,*, Beatrix Gillet-Legrand2,3,*, Corentin Guerinot1,4,5, Jean-Baptiste Masson4, Christian L. Vestergaard4, Melissa Bonner6, Khatuna Gagnidze6, Gabor Veres7, Pierre-Marie Lledo1,*,† & Nathalie Cartier2,3,*,†
1 Institut Pasteur, Université de Paris, CNRS UMR 3571, Perception and Memory Unit, F-75015 Paris, France.
2 INSERM UMR1169, Université Paris-Sud, Université Paris-Saclay, Orsay 94100, France.
3 INSERM UMR1127, Thérapie Cellulaire et Génique des Maladies Neurologiques de l’Enfant et de l’Adulte, Paris Brain Institute (ICM), Hôpital Pitié-Salpêtrière, 47 Boulevard de l’Hôpital, 75013 Paris, France.
4 Laboratory for Decision and Bayesian Computation, Pasteur Institute, Paris, France.
5 Sorbonne Université, Collège doctoral ED3C, F-75005 Paris, France
6 Bluebird Bio, 60 Binney St., Cambridge, MA 02142, USA.
7 Vedere Bio ll, Inc, 700 Technology Sq., Cambridge, MA 02139 USA.
* Ces auteurs ont contribué à part égale à cette recherche
† Auteurs correspondants : KAS, PML, NC.