Une équipe de chercheurs regroupés au sein de ZIKAlliance découvre un mécanisme spécifique de l’infection
Les études épidémiologiques montrent que le fœtus infecté in utero par le virus Zika encourt un risque de microcéphalie, une malformation congénitale du cerveau irréversible caractérisée par un développement incomplet du cortex cérébral. Cependant le mécanisme de la microcéphalie associée au virus Zika reste méconnu. Pour la première fois, une équipe internationale de chercheurs, réunis au sein du consortium européen ZIKAlliance (coordonné par l’Inserm), a identifié un mécanisme spécifique entraînant cette microcéphalie. Leurs travaux sont publiés cette semaine dans Nature Neuroscience.
Pour comprendre ce mécanisme, l’équipe scientifique menée par le Dr Laurent Nguyen (frs-F.N.R.S., GIGA Neuroscience, Université de Liège) et le Pr Marc Lecuit (Institut Pasteur, Inserm, Université Paris Descartes, hôpital Necker-Enfants Malades, AP-HP) a combiné des analyses de fœtus humains infectés par le virus Zika, de cultures de cellules-souches neuronales humaines et d’embryons de souris. Les résultats montrent qu’une infection par le virus Zika des cellules souches neuronales qui contrôlent la neurogenèse déclenche le stress du réticulum endoplasmique (siège de la synthèse de certaines des protéines et des lipides de la cellule) dans les cerveaux embryonnaires, en induisant des signaux en réponse à la conformation incorrecte des protéines.
Lorsqu’il atteint le cerveau, le virus Zika infecte d’une part les cellules-souches neuronales qui vont ainsi générer moins de neurones, et d’autre part, en induisant un stress chronique du réticulum endoplasmique, il favorise l’apoptose, c’est-à-dire la mort précoce de ces cellules neuronales. Ces deux mécanismes cumulés expliquent pourquoi le cortex cérébral des fœtus infectés devient déficitaire en neurones et est donc de taille réduite.
« Ces découvertes démontrent une hypothèse que nous avions émise à la suite d’une étude fondamentale réalisée au préalable au sein de notre laboratoire, et confirme ainsi l’importance physiologique de la réponse à la conformation incorrecte des protéines dans le contrôle de la neurogenèse », explique Laurent Nguyen.
Les chercheurs ont poursuivi leurs études chez la souris en administrant des inhibiteurs de la réponse au repliement incorrect des protéines au sein de cellules souches neuronales, et ils ont constaté que cette opération empêchait le développement de la microcéphalie d’embryons de souris infectés par le virus Zika.
Par ailleurs, les défauts observés sont spécifiques à l’infection par le virus Zika, car d’autres virus neurotropes de la famille des flavivirus (virus du Nil occidental, de la fièvre jaune, ...) ne causent pas de microcéphalie.
Pour le Pr Marc Lecuit, « ces résultats illustrent combien l’étude des processus biologiques fondamentaux est une étape indispensable à la compréhension des mécanismes des infections, et permettent d’entrevoir des débouchés thérapeutiques. »
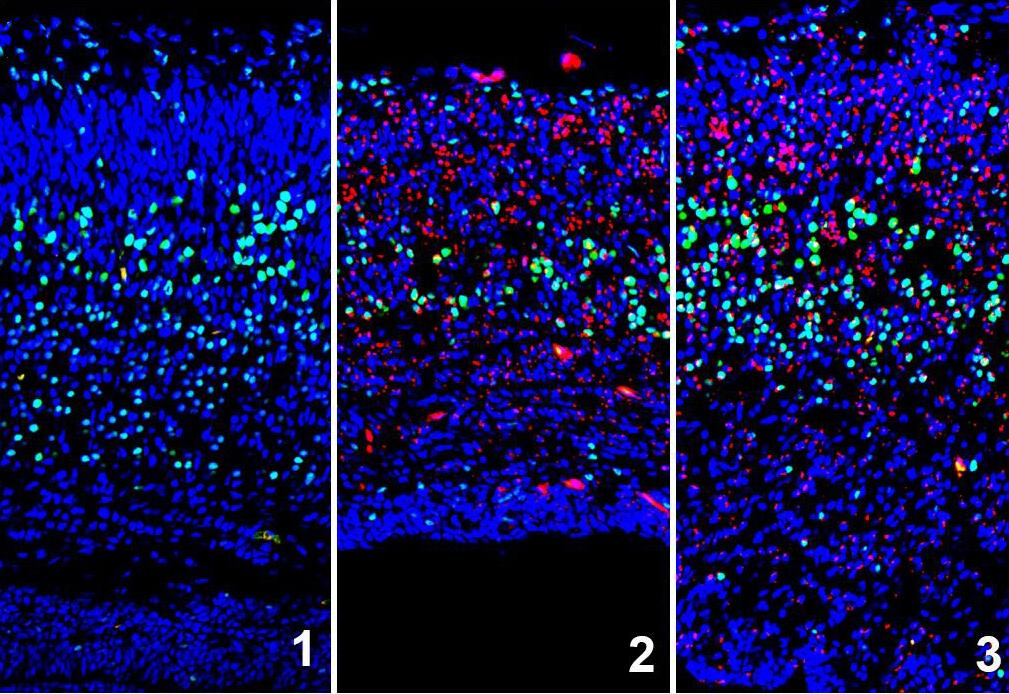
L’infection par le virus Zika provoque la microcéphalie chez la souris en induisant le stress du réticulum endoplasmique (stress de l’ER). La microcéphalie murine résultant de l’infection par Zika est prévenue par l’injection d’une molécule qui réduit l’induction de la réponse au repliement incorrect des protéines (UPR) résultant du stress de l’ER.
Cerveaux d’embryons murins de 18 jours de gestation infectés (2,3) ou non (1) par le virus ZIKA et injectés avec le vecteur (2) ou un bloqueur du stress de l’ER (3) à E12.5. Sections coronales de cerveaux murins correspondants et immunomarqués pour détection du virus ZIKA (NS1, rouge), des neurones des couches profondes (CTIP2, vert), et des noyaux (DAPI, bleu).
A propos du virus Zika
L’infection par virus Zika est une maladie transmise par les moustiques, similaire à la dengue, la fièvre jaune ou la maladie du Nil occidental. Bien que l'infection entraîne souvent chez l’adulte des symptômes bénins, y compris de la fièvre et une éruption cutanée, il a été démontré ces derniers mois que le virus Zika peut être transmis de la mère à son fœtus, et provoquer des microcéphalies. Il peut également être la cause de paralysies graves pouvant atteindre les muscles respiratoires et entraîner la mort chez l’adulte (syndrome de Guillain-Barré).
UE : 45 millions d’euros pour la recherche et la prévention du virus Zika
L'UE soutient la recherche afin de développer des traitements, des diagnostics et des vaccins ainsi qu'une meilleure évaluation des risques pour le virus Zika. La majorité du financement (30 millions €) est consacré à trois consortiums de recherche : ZikaPLAN (11 M €), coordonné par l'Université d'Umeå en Suède, ZIKAction (7 M €), coordonné par la Fondation PENTA en Italie, et ZIKAlliance (12 M €), coordonné par l'Inserm en France. Des chercheurs européens mais aussi du Brésil, d'autres pays d'Amérique latine et des Caraïbes collaborent dans ces consortiums pour mieux connaître l'infection par le virus Zika et ses conséquences pour les femmes enceintes, les nouveau-nés et les adultes, ainsi que pour développer des tests de diagnostic améliorés et déterminer les meilleures options pour le traitement et la prévention.
Plus d’infos : www.zikalliance.tghn.org @ZIKAlliance
Source
Stress-induced unfolded protein response contributes to Zika virus-associated microcephaly, Nature Neuroscience, 11 décembre 2017, doi 10.1038/s41593-017-0038-4
Ivan Gladwyn-Ng (1), Lluis Cordon Barris (1), Christian Alfano (1), Catherine Creppe (1), Thérèse Couderc (2,3), Giovanni Morelli (1,4), Nicolas Thelen (1), Michelle America (1), Bettina Bessières (5,6), Férechté Encha-Razavi (5),Maryse Bonnière (5), Ikuo K. Suzuki (7), Marie Flamand (8), Pierre Vanderhaeghen (7,9), Marc Thiry (1), Marc Lecuit (2,3,10*) and Laurent Nguyen (1*)
(1) GIGA-Neurosciences, Interdisciplinary Cluster for Applied Genoproteomics (GIGA-R), University of Liège, C.H.U. Sart Tilman, Liège, Belgium.
(2) Institut Pasteur, Biology of Infection Unit, Paris, France.
(3) Inserm U1117, Paris, France.
(4) BIOMED - Hasselt University, Hasselt, Belgium.
(5) Département d’Histologie-Embryologie-Cytogénétique, Hôpital Necker-Enfant Malades, Paris, France.
(6) Inserm U 1163 Institut Imagine, Paris, France.
(7) Université Libre de Bruxelles (ULB), Institute for Interdisciplinary Research, (IRIBHM), and ULB Institute of Neuroscience (UNI), Brussels, Belgium.
(8) Institut Pasteur, Structural Virology Unit, Paris, France.
(9) WELBIO, Université Libre de Bruxelles, Brussels, Belgium.
(10) Paris Descartes University, Sorbonne Paris Cité, Division of Infectious Diseases and Tropical Medicine, Necker-Enfants Malades University Hospital, Institut Imagine, Paris, France.
Ivan Gladwyn-Ng, Lluis Cordon Barris, Christian Alfano, Catherine Creppe and Thérèse Couderc contributed equally to this work.
* Corresponding author