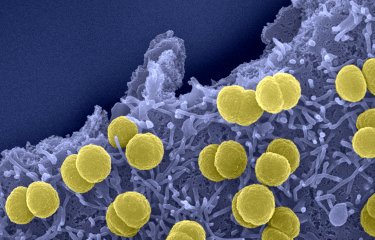
Des chercheurs de l'Institut Cochin, de l'Institut Pasteur, de l'Inserm, de l'AP-HP et de l'Université Paris Descartes ont identifié une protéine présente à la surface du « streptocoque du groupe B » qui lui permet de coloniser et de franchir les barrières de l'hôte, notamment la barrière hémato-encéphalique qui sépare le sang du cerveau. La bactérie peut ainsi engendrer la forme la plus grave de l'infection chez le nouveau-né, la méningite. Ces travaux, mis en ligne en édition avancée, seront publiés dans la revue « Journal of Experimental Medicine » le 25 octobre 2010.
Communiqué de presse
Paris, le 18 octobre 2010
Le streptocoque du groupe B (Streptococcus agalactiae), bactérie normalement présente dans la flore microbienne intestinale des adultes, est la principale cause de méningite chez le nouveau-né. Cette maladie grave est la conséquence du franchissement des barrières intestinale et hémato-encéphalique par cette bactérie. Les barrières intestinale et hémato-encéphalique protègent l’hôte contre la dissémination microbienne dans le sang et le cerveau.
Des études épidémiologiques conduites par le Centre National de Référence des Streptocoques (Hôpital Cochin (AP-HP) et Institut Pasteur) ont montré qu’un clone de streptocoque du groupe B, dénommé ST-17, était responsable de la majorité des infections néonatales et de la quasi-totalité des cas de méningites.
Les équipes dirigées par Claire Poyart (Institut Cochin, Université Paris Descartes, Inserm, AP-HP), Marc Lecuit (Institut Pasteur, Inserm, Université Paris Descartes) et Patrick Trieu-Cuot (Institut Pasteur), ont permis d’élucider les bases moléculaires de l’hypervirulence du clone ST-17, et ainsi de découvrir ce qui lui permet d’être un pathogène redoutable chez le nouveau-né.
Par des approches complémentaires, notamment en reproduisant expérimentalement l’infection néonatale humaine, ils ont démontré qu’une protéine de surface spécifique du clone ST17, dénommée HvgA, était responsable de l’hypervirulence de ce clone. Cette protéine permet en effet au streptocoque d’adhérer in vitro aux cellules constituant les barrières intestinale et hémato-encéphalique. De plus, les chercheurs ont démontré que la protéine HvgA promeut la colonisation intestinale, le franchissement de la barrière intestinale et de la barrière hémato-encéphalique dans les modèles animaux développés pour cette étude.
« Ces résultats apportent la première explication moléculaire rendant compte des capacités du streptocoque du groupe B à induire des méningites chez le nouveau-né » expliquent les auteurs.
La découverte de cette protéine et de son rôle crucial au cours de l’infection pourrait avoir des implications majeures dans la mise au point de nouveaux outils diagnostiques. Cette protéine pourrait aussi constituer une cible vaccinale pour la prévention des méningites à streptocoque du groupe B.
Légende : Streptocoques du groupe B dans du liquide céphalorachidien, phagocytés par polynucléaires neutrophiles.
En savoir plus
Toutes les informations sur les méningtes à l'Institut Pasteur
Source
The surface protein HvgA mediates Group B streptococcus hypervirulence and meningeal tropism in neonates, Journal of Experimental Medicine, 25 octobre 2010.
Asmaa Tazi1 (2,3), Olivier Disson (4,5), Samuel Bellais (1,2), Abdelouhab Bouaboud (1,2), Nicolas Dmytruk (3), Shaynoor Dramsi (6), Michel-Yves Mistou (6), Huot Khun (7), Charlotte Mechler (8), Isabelle Tardieux (1,2), Patrick Trieu-Cuot (6), Marc Lecuit (4,5,9)* Claire Poyart (1,2,3,6)*
(1) Institut Cochin, Université Paris Descartes, Faculté de Médecine, CNRS (UMR 8104), Paris, France
(2) INSERM, U567, 75014 Paris, France
(3) Assistance Publique Hôpitaux de Paris, Service de Bactériologie, Centre National de Référence des Streptocoques, Hôpital Cochin, 75014 Paris, France
(4) Institut Pasteur, Groupe Microorganismes et Barrières de l’Hôte, Paris, France
(5) INSERM Avenir U604, 75015 Paris, France
(6) Institut Pasteur, Unité de Biologie des Bactéries Pathogènes à Gram Positif, URA CNRS 2172, 75015 Paris, France
(7) Unité d’Histotechnologie et Pathologie, Institut Pasteur, Paris
(8) Assistance Publique Hôpitaux de Paris, Service d’Anatomie Pathologique, Hôpital Louis Mourier, 92701 Colombes, France
(9) Université Paris Descartes, Assistance Publique-Hôpitaux de Paris, Service des Maladies Infectieuses et Tropicales, Hôpital Necker-Enfants Malades, 75015 Paris, France
* These authors contributed equally to this work
Contact presse
Service de presse de l’Institut Pasteur
Marion Doucet - 01 45 68 89 28 - marion.doucet@pasteur.fr
Nadine Peyrolo - 01 45 68 81 47 - nadine.peyrolo@pasteur.fr
Université Paris Descartes
01 40 46 18 63 - presse@parisdescartes.fr