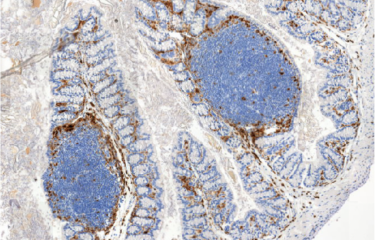
La précolonisation naturelle du tube digestif de souris par Helicobacter hepaticus et la modification du microbiote intestinal empêcheraient le système immunitaire de contrôler efficacement une infection par Mycobacterium tuberculosis, mycobactérie responsable de la tuberculose. Résultat : une corrélation entre la modification du microbiote et la gravité de la tuberculose pulmonaire. C’est la découverte récente de chercheurs de l’Institut Pasteur qui ont étudié, chez la souris, la co-infection par les mycobactéries et les helicobacters.
« On sait aujourd’hui que l’apparition des maladies est un phénomène complexe, et qu’elle n’est pas régie simplement par l’équation "un pathogène entraine une pathologie", introduit Claude Leclerc, responsable de l’unité Régulation immunitaire et vaccinologie à l’Institut Pasteur. On sait que des interactions sont possibles entre les réponses immunitaires induites contre différents pathogènes, entrainant parfois la survenue de symptomes aggravés liès à des co-infections. C’est pourquoi nous nous sommes penchés sur les interactions possibles entre l’infection par Mycobacterium tuberculosis et la persistance d’autres bactéries, jusqu’ici très peu étudiées. »
Rappelons que l’infection latente par M. tuberculosis touche 30% de l’humanité. Le plus souvent, les personnes ayant contracté la bactérie ne développent pas la maladie active. « Chez les souris exemptes d’organismes pathogènes spécifiques, la charge bactérienne pulmonaire dûe à l’infection par M. tuberculosis est généralement bien contrôlée. Cependant, les souris précolonisées naturellement par la bactérie Helicobacter hepaticus développent des symptômes de tuberculose très agravés, ce qui est corrélé avec une modification importante de microbiote intestinal », indique Laleh Majlessi, chercheuse dans l’unité Pathogénomique mycobactérienne intégrée à l’Institut Pasteur. Ces observations ont mis en évidence un possible lien entre la perturbation du microbiote par une bactérie comme Helicobacter hepaticus, qui entraine l’inflammation des muqueuses intestinales, et le contrôle défaillant de la croissance de la mycobactérie responsable de la tuberculose pulmonaire.
« On sait aussi qu’un virus comme le VIH affaiblit le système immunitaire et peut déclencher l’apparition d’une tuberculose grave », ajoute Claude Leclerc. Des observations épidémiologiques et expérimentales, réalisées par les deux équipes, ont ainsi démontré que la colonisation naturelle du tractus digestif par H. hepaticus, chez la souris, est concomitante avec la modification du microbiote intestinal et l’apparition d’une inflammation, puis l’altération importante du contrôle immunitaire de la croissance de M. tuberculosis administrée par la suite. « Nos résultats ont permis de comprendre que cette colonisation par H. hepaticus empêche l’induction de réponses immunitaires efficaces contre M. tuberculosis, expliquent les chercheuses. La croissance des mycobactéries, habituellement contrôlée, ne l’est plus : on observe 1000 fois plus de mycobactéries dans les poumons ! » D’où l’installation d’une inflammation et de la pathologie pulmonaire.
Ces résultats montrent que l’impact de la colonisation microbienne chronique par Helicobacter spp. (équivalent de Helicobacter pylori chez l’homme) sur l’infection ultérieure par M. tuberculosis pourrait être plus important qu’on ne le pensait. Cette découverte est d’autant plus importante que les deux espèces sont parmi les bactéries invasives les plus fréquentes dans les populations humaines. Elle suggère aussi – même si des études approfondies sont encore nécessaires chez l’homme – que, chez les individus porteurs de M. tuberculosis, l’infection par Helicobacteur pylori pourrait avoir un impact possible sur la survenue d’une tuberculose active.
Source
Colonization with Helicobacter is concomitant with modified gut microbiota and drastic failure of the immune control of Mycobacterium tuberculosis. Mucosal Immunol. 1er février 2017.
L Majlessi1,2,3, F Sayes1,2,3, J-F Bureau4, A Pawlik1, V Michel5,6, G Jouvion7,8, M Huerre8,9, M Severgnini10, C Consolandi10, C Peano10, R Brosch1, E Touati5,6 and C Leclerc2,3
1. Institut Pasteur, unité de Pathogénomique mycobactérienne intégrée, Paris, France
2. Institut Pasteur, unité de Régulation immunitaire et vaccinologie, Paris, France
3. INSERM U1041, Paris, France
4. Institut Pasteur, unité de Génétique fonctionnelle des maladies infectieuses, Paris, France
5. Institut Pasteur, unité de Pathogenèse de Helicobacter, Paris, France
6. CNRS ERL3526, Paris, France
7. Institut Pasteur, unité d’Histopathologie humaine et modèles animaux, Paris, France
8. Institut Pasteur, URE Histotechnologie et pathologie, Paris, France
9. Institut Curie, Département de Pathologie, Paris, France
10. Institute of Biomedical Technologies, CNR, Segrate, Milan, Italy